解题方法
1 . 用实验确定某酸HA是否为弱电解质,两位同学的方案如下:
甲:①称取一定质量的HA,配制0.1mol•L-1的溶液100mL;②用pH计测出该溶液的pH,根据测定结果即可判断HA是否为弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸分别配制pH=2的两种酸溶液各100mL;②分别取这两种溶液各10mL,加水稀释为100mL;③各取相同体积的两种稀释液于两支试管中,同时加入相同纯度的锌粒,根据观察到的实验现象即可判断HA是否为弱电解质。
(1)在两个方案的步骤①中,都要用到的定量仪器是____ 。
(2)甲方案中,若测得溶液的pH____ (填“>”“<”或“=”)1,则可说明HA是弱电解质。
(3)乙方案中,能说明HA是弱电解质的现象是____ (填字母序号)。
A.装盐酸的试管中放出H2的速率较大
B.装HA溶液的试管中放出H2的速率较大
C.两支试管中产生气体的速率一样大
(4)请你对两种方案的可行性作出评价____ 。
(5)请你再设计一个合理而比较容易进行的实验方案(药品可任取),并作简明扼要的表述_____ 。
甲:①称取一定质量的HA,配制0.1mol•L-1的溶液100mL;②用pH计测出该溶液的pH,根据测定结果即可判断HA是否为弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸分别配制pH=2的两种酸溶液各100mL;②分别取这两种溶液各10mL,加水稀释为100mL;③各取相同体积的两种稀释液于两支试管中,同时加入相同纯度的锌粒,根据观察到的实验现象即可判断HA是否为弱电解质。
(1)在两个方案的步骤①中,都要用到的定量仪器是
(2)甲方案中,若测得溶液的pH
(3)乙方案中,能说明HA是弱电解质的现象是
A.装盐酸的试管中放出H2的速率较大
B.装HA溶液的试管中放出H2的速率较大
C.两支试管中产生气体的速率一样大
(4)请你对两种方案的可行性作出评价
(5)请你再设计一个合理而比较容易进行的实验方案(药品可任取),并作简明扼要的表述
您最近一年使用:0次
2022-11-25更新
|
85次组卷
|
2卷引用:苏教2020版选择性必修1专题3第四单元 沉淀溶解平衡课后习题
9-10高二下·江西·期中
名校
2 . 将0.1mol•L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起的变化是
| A.溶液的pH增大 | B.CH3COOH的电离度变大 |
| C.溶液中c(OH-)减小 | D.溶液的导电能力减弱 |
您最近一年使用:0次
2022-11-25更新
|
1364次组卷
|
42卷引用:苏教2020版选择性必修1专题3第四单元 沉淀溶解平衡课后习题
苏教2020版选择性必修1专题3第四单元 沉淀溶解平衡课后习题3.4.1沉淀溶解平衡原理 课中(已下线)09~10年江西四校高二下学期期中联考化学卷(已下线)2011-2012学年福建省罗源一中高二上学期期末考试化学试卷(已下线)2010-2011学年安徽省怀宁县高河中学高二下学期第二次月考化学试卷(已下线)2012-2013学年福建省罗源县第一中学高二第二次月考化学试卷(已下线)2012-2013学年广东省实验中学高二上学期期中化学试卷(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2013届上海市金山区高三上学期期末考试化学试卷(已下线)2013-2014学年内蒙古包头三十三中高二下学期期中考试理科化学试卷(已下线)2014届内蒙古包钢一中高二下学期期中Ⅰ考试化学试卷2015-2016学年山东枣庄八中南校区高二12月月考化学卷2015-2016学年山东省临沂一中高二上学期期中测试化学试卷2016届上海市杨浦区高三上学期期末3+1质量调研化学试卷2015-2016学年黑龙江省海林林业局一中高二上期末考试化学试卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第二次月考化学试题吉林省东北师范大学附属中学2017-2018学年高二上学期期末考试化学试题福建省永春县第一中学2017-2018高二下学期期末考试化学试题上海市闵行三中2018.-2019学年高三期中考试试卷上海市复旦大学附中2017-2018学年高二上学期期中考试化学试题江西省南昌市第二中学2019-2020学年高二上学期期中考试化学试题吉林省吉林市普通高中2020届高三上学期第一次调研测试化学试题江西省南昌市顶级名校2019-2020学年高二上学期12月月考化学考试题上海市静安区2020届高三上学期第一次模拟考试化学试题2020届高三化学二轮冲刺新题专练——弱电解质电解常数、电离度及其应用(已下线)考点11 弱电解质的电离及溶液pH-2020年高考化学命题预测与模拟试题分类精编北京市海淀实验中学2019-2020学年高二下学期期末考试化学试题广西壮族自治区贺州市桂梧高中2020-2021学年高二上学期(12月)第二次月考化学试题青海省湟川中学2019-2020学年高二上学期期中考试化学试题第27届(2013年)高中学生化学竞赛天津市预赛试题(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)上海市控江中学2020-2021学年高二下学期等级班期中考试化学试题陕西省安康市六校联考2021-2022学年高二上学期期末考试化学试题(已下线)第07练 电离平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)吉林省长春市北师大附属学校2021-2022学年高二上学期期末考试化学试题湖南省岳阳市华容县2021-2022学年高二上学期期末教学质量监测化学试题江苏省淮安市涟水县第一中学2021-2022学年高二下学期第二次阶段检测化学试题安徽省肥东凯悦中学2021-2022学年高二上学期第三次自主检测化学试题广东省华南师范大学附属中学2022-2023学年高二上学期1月期末化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)陕西省汉中市乡县第一中学2023-2024学年高二上学期10月月考化学试题
名校
3 . 25℃时,三种酸的电离平衡常数如下:
(1)一般情况下,当温度升高时,
_______ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力最强的是_______ (填序号);
a、 b、
b、 c、
c、 d、
d、
(3)下列反应不能发生的是_______ (填序号)
a.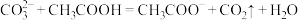
b.
c.
d.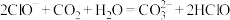
(4)用蒸馏水稀释 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是_______ (填序号);
a.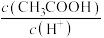 b.
b. c.
c. d.
d.
| 化学式 |  |  |  |
| 电离平衡常数 |  |  , , |  |
(1)一般情况下,当温度升高时,

(2)下列四种离子结合质子能力最强的是
a、
 b、
b、 c、
c、 d、
d、
(3)下列反应不能发生的是
a.
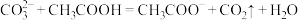
b.

c.

d.
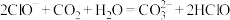
(4)用蒸馏水稀释
 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是a.
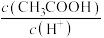 b.
b. c.
c. d.
d.
您最近一年使用:0次
2022-11-08更新
|
355次组卷
|
5卷引用:章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)
(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题江西省遂川中学2021-2022学年高二上学期第二次月考化学(B卷)试题天津市第二十一中学2022-2023学年高二上学期期中调研化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
4 . 下列关于醋酸性质的描述,不能证明它是弱电解质的是
| A.0.1mol·L-1的醋酸溶液中H+浓度约为10-3mol·L-1 |
| B.醋酸溶液中存在CH3COOH分子 |
| C.CH3COONa溶液pH大于7 |
| D.5mL0.1mol·L-1的醋酸溶液与5mL0.1mol·L-1的KOH溶液恰好完全中和 |
您最近一年使用:0次
2022-11-02更新
|
337次组卷
|
5卷引用:第三章 第一节 弱电解质的电离(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)
(已下线)第三章 第一节 弱电解质的电离(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)福建省仙游一中、莆田二中、莆田四中2020-2021学年高二上学期期末联考化学试题广东省化州市第一中学2020-2021学年高二上学期10月月考化学试题四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
2022高二·全国·专题练习
5 . 已知25℃时,电离平衡常数:
回答下列问题:
(1)下列四种物质电离出质子的能力由大到小的顺序是___________ (填标号)。
a、HCO3- b、HClO c、CH3COOH d、H2CO3
(2)下列反应不能发生的是___________。
(3)用蒸馏水稀释0.10mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.4×10-7K2=4.7×10-11 | 3.0×10-8 |
(1)下列四种物质电离出质子的能力由大到小的顺序是
a、HCO3- b、HClO c、CH3COOH d、H2CO3
(2)下列反应不能发生的是___________。
A. |
| B.ClO-+CH3COOH=CH3COO-+HClO |
C.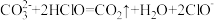 |
D.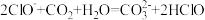 |
A. | B. | C. | D. |
您最近一年使用:0次
6 . 下列事实中,不能说明甲酸(HCOOH)是弱电解质的是
| A.用相同物质的量浓度的盐酸和甲酸溶液做导电性实验,甲酸溶液的灯光较暗 |
| B.甲酸是共价化合物 |
| C.用pH试纸测得0.1 mol·L-1HCOONa溶液的pH>7 |
| D.常温下,新配制的0.1mol·L-1甲酸溶液的pH约为2.37 |
您最近一年使用:0次
2022-10-04更新
|
115次组卷
|
3卷引用:苏教2020版选择性必修1专题3第四单元 沉淀溶解平衡课后习题
10-11高二上·广东东莞·期中
名校
解题方法
7 . 从下列实验事实所引出的相应结论正确的是
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,析出S沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | 物质的量浓度相同的盐酸和醋酸分别与等质量的、形状相同的锌粒反应 | 反应开始时速率相同 |
| D | 在容积可变的密闭容器中发生反应H2(g)+I2(g)  2HI(g),把容积缩小一倍 2HI(g),把容积缩小一倍 | 正反应速率加快,逆反应速率不变 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-28更新
|
440次组卷
|
25卷引用:高二人教版选修4 第二章 第二节 影响化学反应速率的因素
高二人教版选修4 第二章 第二节 影响化学反应速率的因素鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第3节综合训练(已下线)2010年广东省东莞市五校联考高二上学期期中考试化学卷(已下线)2013-2014学年江西省南昌市四校联考高二上学期期中考试化学试卷2015-2016学年四川省宜宾市第三中学高二上学期期中测试化学试卷辽宁省大连育明高级中学2018届高三人教版选修四9.8同步周测二化学试题江西省赣州市崇义中学2017-2018学年高二上学期第一次月考化学试题辽宁省庄河市高级中学2017-2018学年高二10月月考化学试题江苏省启东中学2017-2018学年高一(创新班)上学期期中考试化学试题江西省南昌市第十中学2018-2019学年高二上学期第一次月考化学试题山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题江西省赣县三中2018-2019学年高二上学期9月月考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题江西省九江市九江第一中学2019-2020高二上期期中考试化学试题(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》(已下线)【南昌新东方】江西省九江第一中学2019-2020学年高二上学期期中考试化学试题山西省临猗县临晋中学2020-2021学年高二9月月考化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第一次月考化学试题河北省张家口市第一中学2021-2022学年高二上学期10月月考化学试题甘肃省镇原县第二中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题七 化学反应速率与化学平衡 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)山东省潍坊实验中学2022-2023学年高二上学期第一次单元过关检测化学试题重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题河南省平顶山市汝州第一高级中学2022-2023学年高二10月月考化学试题(已下线)第1讲 化学反应速率及其影响因素
8 . 已知H2A为二元弱酸,25℃时,用Na2A溶液吸收H2A,且最终吸收H2A的量小于原溶液中Na2A的物质的量,其吸收液pH随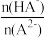 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是

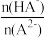 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是
| A.NaHA溶液中:c(H+)>c(OH-) | B.Na2A溶液中:c(A2-)>c(HA-) |
| C.H2A的第二步电离常数为10-7.2 | D.当吸收液呈中性时:c(Na+)=c(A2-)+c(HA-) |
您最近一年使用:0次
2022-09-22更新
|
515次组卷
|
8卷引用:鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系
鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时3 溶液中粒子浓度的大小关系选择性必修1(SJ)专题3第三单元课时3 溶液中粒子浓度的大小关系3.3.3盐类水解的应用 课后微专题(9) 利用图像判断溶液粒子浓度关系湖南H11教育联盟2018年1月高三联考化学试题山东省济南黄河双语实验学校2021-2022学年高二上学期期中考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
名校
解题方法
9 . 下列实验事实不能证明醋酸是弱电解质的是
| A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等 |
| B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4 |
| C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D.相同浓度的盐酸和醋酸,醋酸溶液的导电性比盐酸的弱 |
您最近一年使用:0次
2022-09-22更新
|
809次组卷
|
25卷引用:鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 章末总结
鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 章末总结鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时1 弱电解质的电离平衡(已下线)3.2.1 溶液的酸碱性-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省浠水县实验高级中学2018-2019学年高二上学期12月月考化学试题.江苏省苏州市相城区陆慕高级中学2019-2020高二下学期4月质量检测化学试题贵州省北京师范大学遵义附属学校2019-2020学年高二下学期第二次月考化学试题浙江省天台中学2021-2022学年高二上学期返校考试化学试题(已下线)必考点06 水的电离和溶液pH-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)浙江省“七彩阳光”新高考研究联盟2021-2022学年高二上学期期中联考化学试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期期中考试化学试题(已下线)综合复习与测试(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)四川师范大学附属中学安宁校区2021-2022学年高二上学期期中考试化学试题吉林省延吉市第一高级中学2021-2022年学年高二上学期期中考试化学试题吉林省长春市北师大附属学校2021-2022学年高二上学期期末考试化学试题浙江省舟山市舟山中学2022-2023学年高二上学期阶段性质量监测化学试题河南省洛阳市新安县第一高级中学2021-2022学年高二上学期10月月考化学试题河南省潢川第一中学2022-2023学年高二上学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二上学期期末考试化学试题湖南省株洲市渌口区第三中学2022-2023学年高二下学期期中考试化学试题辽宁省大连市第八中学2022-2023学年高二上学期10月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题河北定州中学2023-2024学年高二上学期12月月考化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题江苏省徐州市第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
10 . 用 溶液分别滴定溶液体积均为20.00mL的
溶液分别滴定溶液体积均为20.00mL的 醋酸溶液和
醋酸溶液和 草酸
草酸 溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是

 溶液分别滴定溶液体积均为20.00mL的
溶液分别滴定溶液体积均为20.00mL的 醋酸溶液和
醋酸溶液和 草酸
草酸 溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
A.X曲线代表草酸,Y曲线代表醋酸, |
B.醋酸溶液在滴定过程中始终有 |
C.若b点时 ,则b点溶液中 ,则b点溶液中 |
D.若a点 ,则a点有 ,则a点有 |
您最近一年使用:0次
2022-09-06更新
|
694次组卷
|
6卷引用:微专题(9) 利用图像判断溶液粒子浓度关系



