1 . 已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法不正确的是
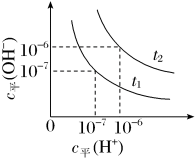

| A.t1<t2 |
| B.一定温度下,改变水溶液中c平(H+)或c平(OH-)的浓度,KW不会发生变化 |
| C.t2温度c平(H+)为1×10-2 mol·L-1的HCl溶液中,水电离出的c平(H+)=1×10-10 mol·L-1 |
| D.将t1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小 |
您最近一年使用:0次
2 . 25 ℃时,下列叙述中错误的是
A.0.1 mol·L-1NH4HS溶液中:c <c <c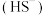 +c +c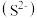 +c +c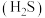 |
B.将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合后,c =c =c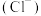 ,则NH3·H2O的电离常数为 ,则NH3·H2O的电离常数为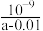 |
| C.10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20 mL |
D.pH相等的① 2SO4溶液,②NH4HSO4溶液,③NH4Cl溶液中,c 2SO4溶液,②NH4HSO4溶液,③NH4Cl溶液中,c 的大小关系:①>③>② 的大小关系:①>③>② |
您最近一年使用:0次
3 . 下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 | HX | HY | HZ | ||
浓度( ) ) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 |  |  |  |  | 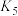 |
A.在相同温度下,从 的数据可以得出: 的数据可以得出: 的浓度越小,电离度越大,且 的浓度越小,电离度越大,且 |
B.常温下,若在 溶液中加水,则 溶液中加水,则 减小 减小 |
C.含等物质的量的 、 、 和 和 的溶液中, 的溶液中, ,且 ,且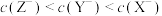 |
D.在相同温度下,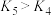 |
您最近一年使用:0次
4 . 部分弱酸的电离平衡常数如下表:
下列选项错误的是
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
A.2CN-+H2O+CO2=2HCN+CO |
B.2HCOOH+CO =2HCOO-+H2O+CO2↑ =2HCOO-+H2O+CO2↑ |
C.由数据可知酸性:HCOOH>H2CO3>HCN>HCO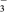 |
| D.25 ℃时,在等浓度的CH3COOH溶液和HCN溶液中,水的电离程度后者大 |
您最近一年使用:0次
2022-07-26更新
|
1497次组卷
|
6卷引用:作业(十四) 水的电离 溶液的酸碱性与 pH
作业(十四) 水的电离 溶液的酸碱性与 pH(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 弱电解质的电离平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)河南省新乡市第一中学2022-2023学年高二上学期第一次月考化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题(已下线)选择题1-5
21-22高二下·四川达州·期末
5 . 酸、碱、盐是中学化学学习的重要化合物,请依据其性质回答下列问题。
(1)常温下,小苏打溶液pH_______ 7(填“>”、“=”或“<”),其理由是_______ (用离子方程式表示),溶液中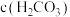
_______  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(2)常温下,将体积均为 、
、 均为12的氨水和
均为12的氨水和 溶液分别加水稀释至1L,溶液
溶液分别加水稀释至1L,溶液 较大的是
较大的是_______ ,稀释后溶液的
_______  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(3)相同温度下,浓度均为 的下列溶液:①
的下列溶液:① ②
② ③
③ ④
④ ,溶液中的
,溶液中的 浓度由大到小的顺序为
浓度由大到小的顺序为_______ (用序号表示)。
(4)已知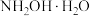 与
与 相似,水溶液具有弱碱性,其电离方程式为:
相似,水溶液具有弱碱性,其电离方程式为: 。常温下,现用盐酸滴定
。常温下,现用盐酸滴定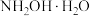 溶液,溶液中由水电离出的
溶液,溶液中由水电离出的 的负对数[
的负对数[ ]与所加盐酸体积的关系如图所示(已知:
]与所加盐酸体积的关系如图所示(已知: )
)

①R、Q两点溶液pH关系是:R_______ Q(填“>”、“=”或“<”),R、Q两点对应溶液中水的电离程度的关系:R_______ Q(填“>”、“=”或“<”)。
②滴定过程中,若 ,则此时溶液中
,则此时溶液中
_______ 。
③N点离子浓度由大到小的顺序为_______ 。
(1)常温下,小苏打溶液pH
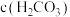
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(2)常温下,将体积均为
 、
、 均为12的氨水和
均为12的氨水和 溶液分别加水稀释至1L,溶液
溶液分别加水稀释至1L,溶液 较大的是
较大的是
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(3)相同温度下,浓度均为
 的下列溶液:①
的下列溶液:① ②
② ③
③ ④
④ ,溶液中的
,溶液中的 浓度由大到小的顺序为
浓度由大到小的顺序为(4)已知
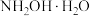 与
与 相似,水溶液具有弱碱性,其电离方程式为:
相似,水溶液具有弱碱性,其电离方程式为: 。常温下,现用盐酸滴定
。常温下,现用盐酸滴定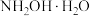 溶液,溶液中由水电离出的
溶液,溶液中由水电离出的 的负对数[
的负对数[ ]与所加盐酸体积的关系如图所示(已知:
]与所加盐酸体积的关系如图所示(已知: )
)
①R、Q两点溶液pH关系是:R
②滴定过程中,若
 ,则此时溶液中
,则此时溶液中
③N点离子浓度由大到小的顺序为
您最近一年使用:0次
2022-06-30更新
|
905次组卷
|
4卷引用:3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)四川省达州市2021-2022学年高二下学期期末检测化学试题辽宁省营口市大石桥市第三高级中学等2校2022-2023学年高二上学期期末考试化学试题辽宁省营口市2022-2023学年高二上学期期末考试化学试题
6 . 工业上以 为原料生产
为原料生产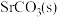 ,对其工艺条件进行研究。现有含
,对其工艺条件进行研究。现有含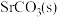 的
的 、
、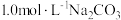 溶液,含
溶液,含 的
的 、
、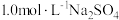 溶液。在一定pH范围内,四种溶液中
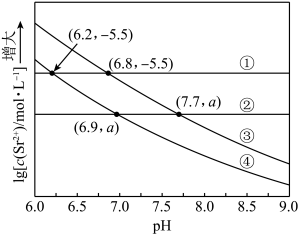
溶液。在一定pH范围内,四种溶液中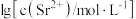 随pH的变化关系如图所示。下列说法错误的是
随pH的变化关系如图所示。下列说法错误的是
 为原料生产
为原料生产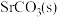 ,对其工艺条件进行研究。现有含
,对其工艺条件进行研究。现有含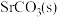 的
的 、
、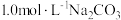 溶液,含
溶液,含 的
的 、
、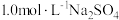 溶液。在一定pH范围内,四种溶液中
溶液。在一定pH范围内,四种溶液中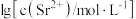 随pH的变化关系如图所示。下列说法错误的是
随pH的变化关系如图所示。下列说法错误的是
A.反应 的平衡常数 的平衡常数 |
B. |
C.曲线④代表含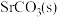 的 的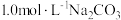 溶液的变化曲线 溶液的变化曲线 |
D.对含 且 且 和 和 初始浓度均为 初始浓度均为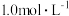 的混合溶液, 的混合溶液,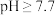 时才发生沉淀转化 时才发生沉淀转化 |
您最近一年使用:0次
2022-06-23更新
|
13574次组卷
|
31卷引用:模块综合检测卷2
模块综合检测卷22022年新高考山东化学高考真题(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年山东省高考真题变式题(不定项选择题)(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第15练 以Ksp的计算突破溶解平衡-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第26讲 难溶电解质的溶解平衡(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)广东省汕头市金山中学2022-2023学年高三上学期第二次月考化学试题(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)考向3 沉淀溶解平衡及其应用辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题湖南省长沙市第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)题型27 沉淀溶解平衡常数及其应用图象四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
21-22高二下·江苏常州·期中
名校
7 . 下列过程中的化学反应,相应的离子方程式正确的是
| H2CO3 | Ka1=4.30×10-7 | Ka2=5.61×10-11 | H2SO3 | Ka1=1.54×10-2 | Ka2=1.02×10-7 |
| HClO | Ka=2.95×10-8 | H2S | Ka1=9.1×10-8 | Ka2=1.1×10-12 |
| A.CuCl2溶液中通入H2S气体:Cu2++S2-=CuS↓ |
B.NaClO溶液中通少量CO2:ClO-+CO2+H2O=HClO+HCO |
C.向Na2S溶液中通入少量SO2:S2-+SO2+H2O=SO +H2S +H2S |
D.Na2CO3溶液中通入过量SO2:CO +SO2=SO +SO2=SO +CO2 +CO2 |
您最近一年使用:0次
21-22高二上·重庆·期末
名校
解题方法
8 . pH值是判断溶液酸碱性的重要参数。室温下 ,下列有关溶液中的pH值判断一定正确的是
| A.pH=4的番茄汁中c(H+)是pH=6的牛奶中c(H+)的100倍 |
| B.pH=2的酸溶液和pH=12的碱溶液等体积混合后pH=7 |
| C.某正盐溶液pH=7,则该盐一定是强酸强碱盐 |
| D.1mol·L-1醋酸溶液加水稀释10倍后1<pH<2 |
您最近一年使用:0次
2022-03-25更新
|
463次组卷
|
3卷引用:3.2.2 溶液的酸碱性与pH-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.2.2 溶液的酸碱性与pH-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)重庆市主城区六校2021-2022学年高二上学期期末联考化学试题浙江金华第一中学2022-2023学年高二上学期12月月考化学试题
21-22高二上·江西·期末
9 . H2A为二元酸,其电离过程为:H2A H++HA-,HA-
H++HA-,HA- H++A2-。常温时,向20mL 0.1mol/L H2A水溶液中逐滴滴加0.1mol/L NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
H++A2-。常温时,向20mL 0.1mol/L H2A水溶液中逐滴滴加0.1mol/L NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
 H++HA-,HA-
H++HA-,HA- H++A2-。常温时,向20mL 0.1mol/L H2A水溶液中逐滴滴加0.1mol/L NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
H++A2-。常温时,向20mL 0.1mol/L H2A水溶液中逐滴滴加0.1mol/L NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是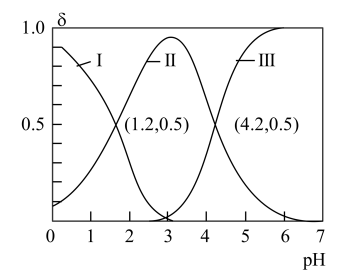
| A.H2A的Kal的数量级为10-1 |
| B.当溶液中c(H2A)=c(A2-)时,pH=2.7 |
| C.曲线Ⅱ表示A2- |
| D.向pH=4.2的溶液中继续滴加NaOH溶液,水的电离程度持续变大 |
您最近一年使用:0次
2022-02-16更新
|
2206次组卷
|
8卷引用:3.1.2 电离平衡常数-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.1.2 电离平衡常数-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)江西省六校2021-2022学年高二上学期期末联考化学试题(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题吉林省长春市十一高中2022-2023学年高二上学期第一学程考试化学试题贵州省凯里市第一中学2022-2023学年高二上学期期末考试化学试题广东省揭阳市惠来县第一中学2022-2023学年高二上学期12月月考化学试题广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题甘肃省白银市靖远县第四中学2023-2024学年高二下学期开学化学试题
21-22高二上·广东·期中
10 . 回答下列各小题
I.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO Ka=4.7×10-8
H2CO3 Ka1=4.3×10-7Ka2=5.6×10-11
H2SO3Ka1=1.5×10-2Ka2=1.0×10-7
(1)相同浓度的ClO—、CO 、HCO
、HCO 、SO
、SO 结合H+的能力由强到弱的顺序为
结合H+的能力由强到弱的顺序为_________ 。
(2)下列离子在溶液中不能大量共存的是_______(填字母)。
(3)室温下,SO2通入NaOH溶液中,在所得溶液中,c(HSO )∶c(SO
)∶c(SO )=10∶1,溶液的pH=
)=10∶1,溶液的pH=___________ 。
II.水在25℃和95℃时电离平衡曲线如图。

(4)在曲线A所对应的温度下,0.1 mol·L-1 HCl溶液由水电离出来的c(H+)=________ mol·L-1。
(5)在曲线A所对应的温度下,0.1 mol·L-1的下列溶液:①HCl ②H2SO4③NH3·H2O ④NaOH,pH由大到小的顺序是_______ (填序号顺序)。
(6)在曲线A所对应的温度下,pH=3的醋酸与pH=11的NaOH等体积混合,所得溶液的pH___________ 7(填“>” “<”或“=”)。
(7)在曲线B所对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的6,则NaOH溶液与H2SO4溶液的体积比为___________ 。
I.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO Ka=4.7×10-8
H2CO3 Ka1=4.3×10-7Ka2=5.6×10-11
H2SO3Ka1=1.5×10-2Ka2=1.0×10-7
(1)相同浓度的ClO—、CO
 、HCO
、HCO 、SO
、SO 结合H+的能力由强到弱的顺序为
结合H+的能力由强到弱的顺序为(2)下列离子在溶液中不能大量共存的是_______(填字母)。
A.SO 、HCO 、HCO | B.HSO 、CO 、CO |
C.SO 、CO 、CO | D.ClO—、HSO |
 )∶c(SO
)∶c(SO )=10∶1,溶液的pH=
)=10∶1,溶液的pH=II.水在25℃和95℃时电离平衡曲线如图。

(4)在曲线A所对应的温度下,0.1 mol·L-1 HCl溶液由水电离出来的c(H+)=
(5)在曲线A所对应的温度下,0.1 mol·L-1的下列溶液:①HCl ②H2SO4③NH3·H2O ④NaOH,pH由大到小的顺序是
(6)在曲线A所对应的温度下,pH=3的醋酸与pH=11的NaOH等体积混合,所得溶液的pH
(7)在曲线B所对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的6,则NaOH溶液与H2SO4溶液的体积比为
您最近一年使用:0次



