名校
解题方法
1 . 常温下,有浓度均为0.1mol·L-1的下列6种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NH3·H2O溶液⑤HCl溶液⑥FeCl3溶液
(1)溶液③pH=10的原因是_______ (用离子方程式表示,下同);溶液④pH=11的原因是_______ 。
(2)溶液①中各离子浓度由大到小的顺序是_______ 。
(3)溶液①和③相比较,pH (NaCN)_______ pH (CH3COONa) (填“>”“<”或“=”)。
(4)25℃时,V1L⑤HCl溶液和V2L②NaOH溶液混合后,混合溶液的pH=12,则V1:V2=___ 。
(5)实验室配制⑥FeCl3溶液时,通常加入少量盐酸,原因是_______ 。
(6)25℃时,向①NaCN溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(7)常温下若③CH3COONa和④CH3COOH的混合溶液中c(Na+) =c(CH3COO-),则该溶液呈_______ 性。(填“酸”“碱”或“中”)
①NaCN溶液②NaOH溶液③CH3COONa溶液④NH3·H2O溶液⑤HCl溶液⑥FeCl3溶液
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(2)溶液①中各离子浓度由大到小的顺序是
(3)溶液①和③相比较,pH (NaCN)
(4)25℃时,V1L⑤HCl溶液和V2L②NaOH溶液混合后,混合溶液的pH=12,则V1:V2=
(5)实验室配制⑥FeCl3溶液时,通常加入少量盐酸,原因是
(6)25℃时,向①NaCN溶液中通入少量CO2,发生反应的离子方程式为
(7)常温下若③CH3COONa和④CH3COOH的混合溶液中c(Na+) =c(CH3COO-),则该溶液呈
您最近一年使用:0次
2022-08-10更新
|
825次组卷
|
5卷引用:3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题辽宁省渤海大学附属高级中学2022-2023学年高二上学期第一次月考化学试题四川省泸县第四中学2022-2023学年高二上学期期中考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
名校
2 . 常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表。下列说法正确的是
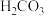 |  |  |
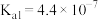 |  | 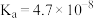 |
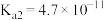 | 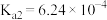 |
A.向 溶液中通入少量 溶液中通入少量 : : |
B.常温下,相同浓度的 溶液和 溶液和 溶液的酸性,后者更强 溶液的酸性,后者更强 |
C.向 溶液中通入少量 溶液中通入少量 : : |
D.向氯水中分别加入等浓度的 溶液和 溶液和 溶液,均可提高氯水中HClO的浓度 溶液,均可提高氯水中HClO的浓度 |
您最近一年使用:0次
2022-08-08更新
|
1276次组卷
|
15卷引用:3.1.2 电离平衡常数-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.1.2 电离平衡常数-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)山西省太原市2018届高三上学期期末考试化学试题【全国百强校】福建省莆田市莆田第一中学2019届高三上学期期中考试化学试题福建省福州市八县一中2020届高三年上学期期中联考化学试题福建省莆田第六中学2020届高三上学期期中考试化学试题福建省莆田第一中学2020届高三上学期12月月考化学试题四川省南充市白塔中学2022届高三第一次月考(9月)化学试题河北省衡水市第十四中学(西校区)2021-2022学年高二上学期二调考试化学试题安徽省亳州市第二中学2021-2022学年高二上学期期中考试化学试题(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练广东省珠海市第一中学2021-2022学年高二上学期期中考试化学试题湖南省邵阳市第二中学2021-2022学年高二下学期入学考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)宁夏六盘山高级中学2023-2024学年高二上学期期中考试化学试题山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期第一次月考化学试题
解题方法
3 . 水的离子积常数与温度有关,回答下列问题:
(1) 时,测得纯水中
时,测得纯水中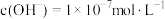 ,则t
,则t___________  (填“>”“<”或“=”),该温度下,
(填“>”“<”或“=”),该温度下,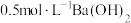 溶液的
溶液的
___________ 。
(2) 时,浓度相同的
时,浓度相同的 和
和 的混合溶液中,
的混合溶液中,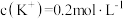 ,则溶液中
,则溶液中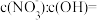
___________ 。
(3) 时,
时, 的某强酸和
的某强酸和 的某强碱按体积比
的某强碱按体积比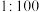 混合后,溶液恰好呈中性,则
混合后,溶液恰好呈中性,则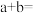
___________ 。
(1)
 时,测得纯水中
时,测得纯水中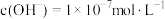 ,则t
,则t (填“>”“<”或“=”),该温度下,
(填“>”“<”或“=”),该温度下,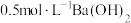 溶液的
溶液的
(2)
 时,浓度相同的
时,浓度相同的 和
和 的混合溶液中,
的混合溶液中,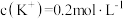 ,则溶液中
,则溶液中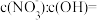
(3)
 时,
时, 的某强酸和
的某强酸和 的某强碱按体积比
的某强碱按体积比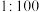 混合后,溶液恰好呈中性,则
混合后,溶液恰好呈中性,则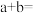
您最近一年使用:0次
2022-07-25更新
|
506次组卷
|
3卷引用:3.2.2 溶液的酸碱性与pH-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.2.2 溶液的酸碱性与pH-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)四川省资阳市2021-2022学年高二下学期期末考试化学试题四川省资阳市雁江区保和中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
4 . 25℃时,下列有关叙述正确的是
| A.饱和氯水中滴加NaOH至溶液呈中性:c(Na+)=2c(ClO-)+c(HClO) |
| B.若HA的Ka=1.7×10-5,BOH的Kb=1.7×10-5,则HA溶液中的c(H+)与BOH中的c(OH-)相等 |
| C.向10mLpH=12的NaOH溶液中滴加pH=2的HA溶液至中性:则混合液体积V(总)≥20mL |
| D.在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-8mol/L |
您最近一年使用:0次
2022-07-14更新
|
404次组卷
|
3卷引用:3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)四川省遂宁市2021-2022学年高二下学期期末考试化学试题江西省宜春市丰城市2022-2023学年高二上学期期中考试化学试题
2022高三·全国·专题练习
5 . 根据酸碱质子理论,给出质子 的物质是酸,给出质子的能力越强,酸性越强。已知:
的物质是酸,给出质子的能力越强,酸性越强。已知: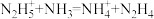 ,
,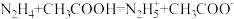 ,下列酸性强弱顺序正确的是
,下列酸性强弱顺序正确的是
 的物质是酸,给出质子的能力越强,酸性越强。已知:
的物质是酸,给出质子的能力越强,酸性越强。已知: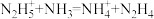 ,
,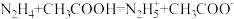 ,下列酸性强弱顺序正确的是
,下列酸性强弱顺序正确的是A.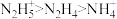 | B.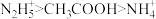 |
C. | D.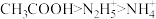 |
您最近一年使用:0次
2022-07-12更新
|
7176次组卷
|
30卷引用:作业(十三) 电离平衡常数
作业(十三) 电离平衡常数(已下线)专题06 物质结构元素周期律-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题11-15湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题(已下线)第23讲 弱电解质的电离平衡(练)-2023年高考化学一轮复习讲练测(全国通用)广东省汕头市金山中学2022-2023学年高三上学期开学考试化学试题湖南省株洲市攸县第一中学2022-2023学年高三上学期第一次月考化学试题天津市第一中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点23 弱电解质的电离平衡-备战2023年高考化学考试易错题江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题广东省中山大学附属中学2022-2023学年高二上学期期中考试化学试题湖北省襄阳市第四中学2022-2023学年高一上学期月考化学试题辽宁省营口市2022-2023学年高三上学期期末考试化学试题(已下线)专题卷13 溶液中粒子浓度大小比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)河北省秦皇岛市青龙满族自治县2023届高三三模联考化学试题(已下线)第14练 水溶液中粒子浓度的关系判断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河北省邢台市临城县等4地邢台市第二中学等2校2022-2023学年高三上学期12月月考化学试题四川省成都市第七中学2023-2024学年高二上学期10月月考化学试题江西省永修县第一中学2023-2024学年高二上学期10月月考化学试题第1讲 弱电解质的电离平衡湖北省/武汉市硚口区武汉第十一中学2023-2024学年高一上学期10月月考化学试题四川省内江市2023-2024学年第一中学高二上学期化学试卷江苏省南京师范大学附属中学2023-2024学年高一上学期期中考试化学试卷海南省文昌中学、华迈实验中学2023-2024学年高二上学期期中段考化学试题湖南省益阳市2023-2024学年高二上学期普通高中期末质量检测化学试题江西省宜春市丰城市第九中学日新班2023-2024学年高一上学期期末考试化学试题广东省深圳实验学校高中部2023-2024学年高一上学期第二阶段考试化学试题 (已下线)FHgkyldyjhx09
6 . 常温下,向20mL 的HA溶液中滴加未知浓度的NaOH溶液,测得混合溶液的温度、pH随加入NaOH溶液体积的变化如图所示,下列说法正确的是
的HA溶液中滴加未知浓度的NaOH溶液,测得混合溶液的温度、pH随加入NaOH溶液体积的变化如图所示,下列说法正确的是
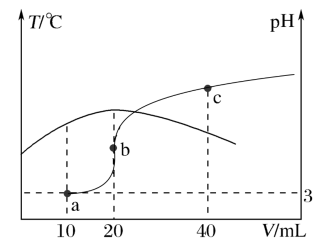
 的HA溶液中滴加未知浓度的NaOH溶液,测得混合溶液的温度、pH随加入NaOH溶液体积的变化如图所示,下列说法正确的是
的HA溶液中滴加未知浓度的NaOH溶液,测得混合溶液的温度、pH随加入NaOH溶液体积的变化如图所示,下列说法正确的是
| A.滴定时,可用甲基橙作指示剂 |
| B.从a点至c点的过程中,水的电离程度逐渐增大 |
C.b点对应溶液中: |
D.a、b、c三点对应温度下HA的电离平衡常数: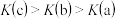 |
您最近一年使用:0次
2022高三·全国·专题练习
7 . 相同温度下,根据三种酸的电离常数,下列判断正确的是
| 酸 | HX | HY | HZ |
| 电离常数K/(mol·L-1) | 9×10-7 | 9×10-6 | 1×10-2 |
| A.三种酸的强弱关系:HX>HY>HZ |
| B.反应HZ+Y-=HY+Z-不能够发生 |
C.V升HY溶液,加入水使溶液体积为2V,则Q= K(HY),平衡正向移动,促进HY电离 K(HY),平衡正向移动,促进HY电离 |
D.0.1mol·L-1HX溶液加水稀释, 值变小 值变小 |
您最近一年使用:0次
2022-07-10更新
|
774次组卷
|
5卷引用:作业(十三) 电离平衡常数
作业(十三) 电离平衡常数(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第30练 电离平衡-2023年高考化学一轮复习小题多维练(全国通用)第三章 第一节 电离平衡江西省宜春市丰城市第九中学日新班2023-2024学年高一上学期期末考试化学试题
名校
解题方法
8 . 常温下,下列说法一定正确的是
| A.常温下,将pH=9的CH3COONa溶液与pH=9的NaOH溶液混合,溶液pH仍为9 |
B.同温下,浓度均为 的CH3COOH溶液与HCl溶液,两溶液导电能力相同 的CH3COOH溶液与HCl溶液,两溶液导电能力相同 |
C.稀释 的HCl溶液,溶液中的所有离子浓度均下降 的HCl溶液,溶液中的所有离子浓度均下降 |
| D.pH=7的CH3COONH4溶液和pH=7的NaCl溶液,两溶液中水的电离程度相等 |
您最近一年使用:0次
2022-07-06更新
|
265次组卷
|
3卷引用:3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)云南省弥勒市第一中学2021-2022学年高二下学期第四次月考化学试题云南省巍山彝族回族自治县第二中学2021-2022学年高二下学期6月第三次月考化学试题
解题方法
9 . 回答下列问题:
(1)用离子方程式表示碳酸钠溶液显碱性的主要原因:_______ 。
(2)亚磷酸( )与足量NaOH溶液反应生成
)与足量NaOH溶液反应生成 ,从分类角度来看,
,从分类角度来看, 属于
属于_______ (选填“酸式盐”、“正盐”或“碱式盐”)。
(3)等体积、等物质的量浓度的三种溶液:①盐酸②醋酸③硫酸,用某浓度NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小顺序为_______ (用序号表示)。
(4)常温下,等体积、等物质的量浓度的盐酸与氨水混合后,溶液中水电离出的
_______ (填“>”、“=”或“<”) 。
。
(5)25℃,向物质的量浓度均为 的
的 和
和 混合溶液中,滴加
混合溶液中,滴加 溶液,首先沉淀的离子是
溶液,首先沉淀的离子是_______ ,当两种难溶电解质均沉淀时,溶液中
_______ 。[25℃,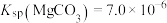 ,
, ]
]
(1)用离子方程式表示碳酸钠溶液显碱性的主要原因:
(2)亚磷酸(
 )与足量NaOH溶液反应生成
)与足量NaOH溶液反应生成 ,从分类角度来看,
,从分类角度来看, 属于
属于(3)等体积、等物质的量浓度的三种溶液:①盐酸②醋酸③硫酸,用某浓度NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小顺序为
(4)常温下,等体积、等物质的量浓度的盐酸与氨水混合后,溶液中水电离出的

 。
。(5)25℃,向物质的量浓度均为
 的
的 和
和 混合溶液中,滴加
混合溶液中,滴加 溶液,首先沉淀的离子是
溶液,首先沉淀的离子是
 ,
, ]
]
您最近一年使用:0次
解题方法
10 . 常温下,向10mL浓度为 醋酸(
醋酸(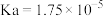 )中滴加相同浓度的氨水(
)中滴加相同浓度的氨水(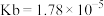 ),在滴加过程中下列说法正确的是
),在滴加过程中下列说法正确的是
 醋酸(
醋酸(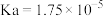 )中滴加相同浓度的氨水(
)中滴加相同浓度的氨水(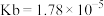 ),在滴加过程中下列说法正确的是
),在滴加过程中下列说法正确的是| A.水的电离程度始终增大 |
B.当加入氨水的体积为10mL时, 与 与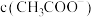 近似相等 近似相等 |
C.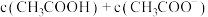 之和始终保持不变 之和始终保持不变 |
D.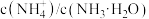 先增大后减小 先增大后减小 |
您最近一年使用:0次



