名校
1 . 烟气中的 会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
方法1(双碱法):用NaOH吸收 ,并用CaO使NaOH再生,即NaOH溶液
,并用CaO使NaOH再生,即NaOH溶液
 溶液。
溶液。
(1)过程①的离子方程式为_______ 。
(2)常温下,用NaOH溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡_______ (填“向左”“向右”或“不”)移动。该溶液中由水电离出的
_______  ;
; 溶液显
溶液显_______ (填“酸”、“碱”或“中”)性。(常温下 的电离平衡常数
的电离平衡常数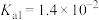 ,
, )
)
(3)CaO在水中存在如下转化: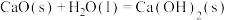 ,
,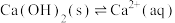
 ,从化学反应原理的角度解释过程②NaOH再生的原理:
,从化学反应原理的角度解释过程②NaOH再生的原理:_______ 。
(4)理论上,该工艺中NaOH只作为启动碱,实际主要消耗的是生石灰。实际吸收过程中,由于存在一定氧气,会发生副反应:_______ (填化学方程式),因副产物_______ (填化学式)在工艺中较难循环再生成NaOH,需要不断向系统中补充NaOH。
方法2:用氨水除去。
(5)已知常温时 的
的 ,若氨水的浓度为
,若氨水的浓度为 ,溶液中
,溶液中
_______  。将
。将 通入该氨水中,当溶液恰好呈中性时,溶液中
通入该氨水中,当溶液恰好呈中性时,溶液中
_______ 。
 会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:方法1(双碱法):用NaOH吸收
 ,并用CaO使NaOH再生,即NaOH溶液
,并用CaO使NaOH再生,即NaOH溶液
 溶液。
溶液。(1)过程①的离子方程式为
(2)常温下,用NaOH溶液吸收
 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡
 ;
; 溶液显
溶液显 的电离平衡常数
的电离平衡常数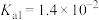 ,
, )
)(3)CaO在水中存在如下转化:
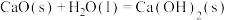 ,
,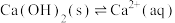
 ,从化学反应原理的角度解释过程②NaOH再生的原理:
,从化学反应原理的角度解释过程②NaOH再生的原理:(4)理论上,该工艺中NaOH只作为启动碱,实际主要消耗的是生石灰。实际吸收过程中,由于存在一定氧气,会发生副反应:
方法2:用氨水除去。
(5)已知常温时
 的
的 ,若氨水的浓度为
,若氨水的浓度为 ,溶液中
,溶液中
 。将
。将 通入该氨水中,当溶液恰好呈中性时,溶液中
通入该氨水中,当溶液恰好呈中性时,溶液中
您最近一年使用:0次
2 . 已知:25℃时,①亚硫酸( )的电离平衡常数为
)的电离平衡常数为 ,
, ;②次氯酸(HClO)的电离平衡常数为
;②次氯酸(HClO)的电离平衡常数为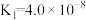 ;③碳酸(
;③碳酸( )的电离平衡常数为
)的电离平衡常数为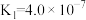 ,
, 。回答下列问题:
。回答下列问题:
(1)HClO的电离方程式为_______ 。
(2)上述三种酸由强到弱的顺序为_______ (填分子式)。
(3)向 溶液中加入
溶液中加入 溶液时,溶液中
溶液时,溶液中
_______ (填“增大”、“减小”或“不变”,下同),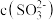
_______ 。
(4)足量的 溶液和
溶液和 溶液发生反应的主要离子方程式为
溶液发生反应的主要离子方程式为_______ ;足量的 溶液中加入NaClO溶液发生反应的离子方程式为
溶液中加入NaClO溶液发生反应的离子方程式为_______ 。
(5)向 的HClO溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的
的HClO溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的 ,则溶液中
,则溶液中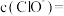
_______  。
。
 )的电离平衡常数为
)的电离平衡常数为 ,
, ;②次氯酸(HClO)的电离平衡常数为
;②次氯酸(HClO)的电离平衡常数为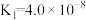 ;③碳酸(
;③碳酸( )的电离平衡常数为
)的电离平衡常数为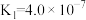 ,
, 。回答下列问题:
。回答下列问题:(1)HClO的电离方程式为
(2)上述三种酸由强到弱的顺序为
(3)向
 溶液中加入
溶液中加入 溶液时,溶液中
溶液时,溶液中
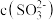
(4)足量的
 溶液和
溶液和 溶液发生反应的主要离子方程式为
溶液发生反应的主要离子方程式为 溶液中加入NaClO溶液发生反应的离子方程式为
溶液中加入NaClO溶液发生反应的离子方程式为(5)向
 的HClO溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的
的HClO溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的 ,则溶液中
,则溶液中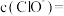
 。
。
您最近一年使用:0次
名校
解题方法
3 . 溶液中的化学反应大多是离子反应。请回答下列问题:
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH_______ a+2(填“>”或“<”)
(2)0.01mol·Lˉ1CH3COOH溶液的pH_______ 2(填“>”或“<”);
(3)0.1mol·Lˉ1CH3COONa溶液的pH_______ 7(填“>”或“<”);
(4)FeCl3溶液呈_______ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______ ;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,_______ (填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(5)若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)_______ c(CH3COO-)(填“>”“<”或“=”)。
(6)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:_______ (用离子方程式表示);
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH
(2)0.01mol·Lˉ1CH3COOH溶液的pH
(3)0.1mol·Lˉ1CH3COONa溶液的pH
(4)FeCl3溶液呈
(5)若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
(6)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)已知室温时,0.1 mol∙L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
① 该溶液中c(H+)=___________ mol∙L-1
② HA的电离平衡常数K=___________ 。
③ 由HA电离出的c(H+)约为水电离出的c(H+)的___________ 倍。
(2)部分弱酸的电离平衡常数如表:用“>”“<”或“=”填空。
①在相同浓度的HCOOH和HClO的溶液中,溶液导电能力:HCOOH___________ HClO。
②将少量CO2气体通入NaClO溶液中,写出该反应离子方程式___________ 。
(3)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是___________ (填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________ 。
③V1和V2的关系:V1___________ V2(填“>”、“=”或“<”)。
(1)已知室温时,0.1 mol∙L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
① 该溶液中c(H+)=
② HA的电离平衡常数K=
③ 由HA电离出的c(H+)约为水电离出的c(H+)的
(2)部分弱酸的电离平衡常数如表:用“>”“<”或“=”填空。
| 弱酸 | HCOOH | H2CO3 | HClO |
| 电离平衡常数/25 ℃ | K=1.77×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
②将少量CO2气体通入NaClO溶液中,写出该反应离子方程式
(3)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是
③V1和V2的关系:V1
您最近一年使用:0次
2022-03-25更新
|
405次组卷
|
4卷引用:3.2.3 酸碱中和滴定-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.2.3 酸碱中和滴定-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)四川省南充市阆中中学校2021-2022学年高二下学期第一学月学习质量监测化学试题四川省绵竹中学2023-2024学年高二上学期第二次月考化学试题四川省阆中东风中学校2023-2024学年高二上学期第二次段考化学试题
名校
解题方法
5 . I.平衡思想是化学研究的一个重要观念,在水溶液中存在多种平衡体系。
(1)实验室在保存FeCl3溶液时,常在溶液中加少量的_______ ,以抑制其水解;把 溶液蒸干并灼烧,最后得到的固体主要产物是
溶液蒸干并灼烧,最后得到的固体主要产物是_______ 。
(2)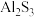 无法在水溶液中制备,原因是:
无法在水溶液中制备,原因是:_______ (用离子方程式解释)
II.已知,常温下几种物质的电离常数如表:
(3)25℃时,CH3COONH4溶液显_______ 性,(NH4)2CO3溶液的pH_______ (填“大于”或“小于”)7
(4)已知NaHSO3溶液显酸性,则溶液中的离子浓度由大到小的顺序为_______ ;溶液中的质子守恒表达式为:_______ 。
(5)25℃时,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=_______ mol·L-1将SO2通入该氨水中,当c(OH−)降至1.0×10-7mol·L-1时,溶液中的 =
=_______ 。SO2可用足量小苏打溶液吸收,反应的离子方程式是_______ 。
(6)将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中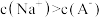 ,则:
,则:
①混合溶液中,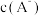
_______  (填“>”“=”或“<”,下同)。
(填“>”“=”或“<”,下同)。
②混合溶液中,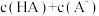
_______ 0.1mol/L。
(1)实验室在保存FeCl3溶液时,常在溶液中加少量的
 溶液蒸干并灼烧,最后得到的固体主要产物是
溶液蒸干并灼烧,最后得到的固体主要产物是(2)
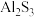 无法在水溶液中制备,原因是:
无法在水溶液中制备,原因是:II.已知,常温下几种物质的电离常数如表:
| 化学式 | H2CO3 | CH3COOH | NH3·H2O | H2SO3 |
| 电离平衡常数 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=1.8×10-5 | Kb=1.8×10-5 | Ka1=1.4×10-2 Ka2=6.0×10-8 |
(4)已知NaHSO3溶液显酸性,则溶液中的离子浓度由大到小的顺序为
(5)25℃时,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=
 =
=(6)将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中
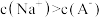 ,则:
,则:①混合溶液中,
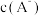
 (填“>”“=”或“<”,下同)。
(填“>”“=”或“<”,下同)。②混合溶液中,
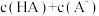
您最近一年使用:0次
2022-03-16更新
|
367次组卷
|
3卷引用:3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷2024届山东省潍坊实验中学高三上学期模拟预测化学试题
6 . 有下列物质:①石墨:②稀硫酸;③ ;④氨水;⑤KHS;⑥
;④氨水;⑤KHS;⑥ ;⑦
;⑦ ;⑧HCl;⑨
;⑧HCl;⑨ 。
。
(1)下列属于强电解质的是___________ ;下列属于非电解质的是___________ 。
(2)写出⑤⑥在相应条件下的电离或水解方程式:
⑤的水解离子方程式___________ 。
⑥水溶液电离方程式___________ 。
(3)向⑧溶液中加入醋酸钠晶体后,与足量的Zn粒反应,产生氢气的速率___________ (填“变快”、“变慢”、“不变”);产生氢气的总量___________ (填“增多”、“减少”、“不变”)。
 ;④氨水;⑤KHS;⑥
;④氨水;⑤KHS;⑥ ;⑦
;⑦ ;⑧HCl;⑨
;⑧HCl;⑨ 。
。(1)下列属于强电解质的是
(2)写出⑤⑥在相应条件下的电离或水解方程式:
⑤的水解离子方程式
⑥水溶液电离方程式
(3)向⑧溶液中加入醋酸钠晶体后,与足量的Zn粒反应,产生氢气的速率
您最近一年使用:0次
2021高二·全国·专题练习
7 . 常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
(1)加适量醋酸钠晶体后,醋酸溶液中c(H+)_______ (填“增大”“减小”或“不变”,下同),盐酸中c(H+)______ 。
(2)加水稀释10倍后,醋酸溶液中的c(H+)______ (填“>”“=”或“<”)盐酸中的c(H+)。
(3)加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸_______ (填“>”“=”或“<”)盐酸。
(4)使温度都升高20℃,溶液中c(H+):醋酸________ (填“>”“=”或“<”)盐酸。
(5)分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示醋酸)
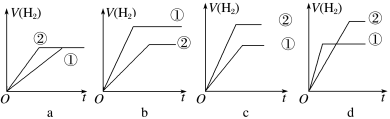
(1)加适量醋酸钠晶体后,醋酸溶液中c(H+)
(2)加水稀释10倍后,醋酸溶液中的c(H+)
(3)加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸
(4)使温度都升高20℃,溶液中c(H+):醋酸
(5)分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

您最近一年使用:0次
2021高二·全国·专题练习
8 . 已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O H++Cl-+HClO、HClO
H++Cl-+HClO、HClO H++ClO-,达到平衡后:
H++ClO-,达到平衡后:
(1)要使HClO的浓度增大,可加入下列哪种物质___________(填代号)。
(2)由此说明在实验室里可用排饱和食盐水收集Cl2的理由是___________ 。
 H++Cl-+HClO、HClO
H++Cl-+HClO、HClO H++ClO-,达到平衡后:
H++ClO-,达到平衡后:(1)要使HClO的浓度增大,可加入下列哪种物质___________(填代号)。
| A.SO2 | B.NaHCO3 | C.HCl | D.NaOH |
您最近一年使用:0次
9 . 回答下列各小题
I.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO Ka=4.7×10-8
H2CO3 Ka1=4.3×10-7Ka2=5.6×10-11
H2SO3Ka1=1.5×10-2Ka2=1.0×10-7
(1)相同浓度的ClO—、CO 、HCO
、HCO 、SO
、SO 结合H+的能力由强到弱的顺序为
结合H+的能力由强到弱的顺序为_________ 。
(2)下列离子在溶液中不能大量共存的是_______(填字母)。
(3)室温下,SO2通入NaOH溶液中,在所得溶液中,c(HSO )∶c(SO
)∶c(SO )=10∶1,溶液的pH=
)=10∶1,溶液的pH=___________ 。
II.水在25℃和95℃时电离平衡曲线如图。

(4)在曲线A所对应的温度下,0.1 mol·L-1 HCl溶液由水电离出来的c(H+)=________ mol·L-1。
(5)在曲线A所对应的温度下,0.1 mol·L-1的下列溶液:①HCl ②H2SO4③NH3·H2O ④NaOH,pH由大到小的顺序是_______ (填序号顺序)。
(6)在曲线A所对应的温度下,pH=3的醋酸与pH=11的NaOH等体积混合,所得溶液的pH___________ 7(填“>” “<”或“=”)。
(7)在曲线B所对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的6,则NaOH溶液与H2SO4溶液的体积比为___________ 。
I.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO Ka=4.7×10-8
H2CO3 Ka1=4.3×10-7Ka2=5.6×10-11
H2SO3Ka1=1.5×10-2Ka2=1.0×10-7
(1)相同浓度的ClO—、CO
 、HCO
、HCO 、SO
、SO 结合H+的能力由强到弱的顺序为
结合H+的能力由强到弱的顺序为(2)下列离子在溶液中不能大量共存的是_______(填字母)。
A.SO 、HCO 、HCO | B.HSO 、CO 、CO |
C.SO 、CO 、CO | D.ClO—、HSO |
 )∶c(SO
)∶c(SO )=10∶1,溶液的pH=
)=10∶1,溶液的pH=II.水在25℃和95℃时电离平衡曲线如图。

(4)在曲线A所对应的温度下,0.1 mol·L-1 HCl溶液由水电离出来的c(H+)=
(5)在曲线A所对应的温度下,0.1 mol·L-1的下列溶液:①HCl ②H2SO4③NH3·H2O ④NaOH,pH由大到小的顺序是
(6)在曲线A所对应的温度下,pH=3的醋酸与pH=11的NaOH等体积混合,所得溶液的pH
(7)在曲线B所对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的6,则NaOH溶液与H2SO4溶液的体积比为
您最近一年使用:0次
名校
10 . Ⅰ.已知t℃时,0.01 mol/L NaOH溶液的pH=10,0.1mol/L的HA溶液中 =108。请回答下列问题:
=108。请回答下列问题:
(1)该温度下,水的离子积kw=___________ 。
(2)该温度下,0.1mol/L的HA溶液中水电离出c(OH-)=___________ 。
(3)该温度下,100 mL pH=a的稀硫酸与10 mL pH=b的NaOH溶液混合,溶液呈中性,则a、b的关系为______ 。
(4)在室温下,蒸馏水稀释0.01mol/L HA溶液时,下列呈减小趋势的是___________。
Ⅱ.室温下,取pH=2的盐酸和HA溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

(5)图中表示HA溶液pH变化曲线的是______ (填“A”或“B”)。
(6)设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1______ m2填“>”<”或“=”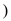 。
。
 =108。请回答下列问题:
=108。请回答下列问题:(1)该温度下,水的离子积kw=
(2)该温度下,0.1mol/L的HA溶液中水电离出c(OH-)=
(3)该温度下,100 mL pH=a的稀硫酸与10 mL pH=b的NaOH溶液混合,溶液呈中性,则a、b的关系为
(4)在室温下,蒸馏水稀释0.01mol/L HA溶液时,下列呈减小趋势的是___________。
| A.水的电离程度 | B. |
| C.溶液中c(H+)和c(OH-)的乘积 | D.溶液中c(A-)•c(HA)的值 |
Ⅱ.室温下,取pH=2的盐酸和HA溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

(5)图中表示HA溶液pH变化曲线的是
(6)设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1
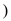 。
。
您最近一年使用:0次



