1 . 在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,请填写下列空白。
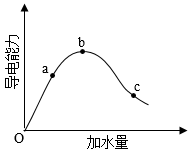
(1)加水前导电能力约为零的原因是___________ 。
(2)a、b、c三点对应的溶液中, 由小到大的顺序是
由小到大的顺序是___________ 。
(3)a、b、c三点对应的溶液中, 电离程度最大的是
电离程度最大的是___________ 。
(4)若使b点对应的溶液中 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是___________ (填序号)。
①加入
②加入NaOH固体
③加入浓硫酸
④加入 固体
固体

(1)加水前导电能力约为零的原因是
(2)a、b、c三点对应的溶液中,
 由小到大的顺序是
由小到大的顺序是(3)a、b、c三点对应的溶液中,
 电离程度最大的是
电离程度最大的是(4)若使b点对应的溶液中
 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是①加入

②加入NaOH固体
③加入浓硫酸
④加入
 固体
固体
您最近一年使用:0次
2021-12-01更新
|
942次组卷
|
2卷引用:人教2019版选择性必修一第三章 第一节 电离平衡 课后习题
2 . 向稀氨水中分别加入下列物质,请判断电离平衡移动的方向。
加入的物质 |
| NH3 | NaOH |
电离平衡移动的方向 |
您最近一年使用:0次
3 . 已知某温度下有如下三个反应:



则该温度下HF、HCN和 三种弱酸的电离常数由大到小的顺序是
三种弱酸的电离常数由大到小的顺序是___________ 。



则该温度下HF、HCN和
 三种弱酸的电离常数由大到小的顺序是
三种弱酸的电离常数由大到小的顺序是
您最近一年使用:0次
4 . 已知t℃时, 0.01 mol/L NaOH溶液的pH= 11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=109请回答下列问题:
(1)该温度下,水的离子积Kw=_______ ,0.1mol/L的HA溶液中水电离出的c(OH-)=_______ 。
(2)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_______。
(3)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1_______ m2(填“>”“<”或“=”)。
(4)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者_______ 后者(填“>”“<”或“=”)。
(1)该温度下,水的离子积Kw=
(2)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_______。
| A.水的电离程度 | B.c(HA)/c(A-) |
| C.溶液中c(H+)和c(OH- )的乘积 | D.溶液中c(OH- )的值 |

设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1
(4)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者
您最近一年使用:0次
2021-11-12更新
|
304次组卷
|
3卷引用:3.2.1 水的电离-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.2.1 水的电离-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)江西省赣州市十六县(市)十七校2021-2022 学年高二上学期中联考化学试题山东省新泰市第一中学(弘文部)2023-2024学年高二上学期第二次月考化学试题
2021高三·全国·专题练习
5 . 已知草酸为二元弱酸:H2C2O4 HC2O
HC2O +H+ Ka1,HC2O
+H+ Ka1,HC2O
 C2O
C2O +H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O
+H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
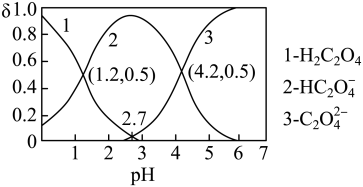
则常温下:
(1)Ka1=________ 。
(2)Ka2=________ 。
(3)pH=2.7时,溶液中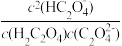 =
=__________________________ 。
 HC2O
HC2O +H+ Ka1,HC2O
+H+ Ka1,HC2O
 C2O
C2O +H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O
+H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
则常温下:
(1)Ka1=
(2)Ka2=
(3)pH=2.7时,溶液中
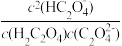 =
=
您最近一年使用:0次
名校
6 . 常温下,有浓度均为0.1 mol·L-l的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是___________ (填标号),其中②由水电离的H+浓度为___________ mol/L。
(2)①中各离子浓度由大到小的顺序是___________ 。
(3)④的水解平衡常数Kh=___________ 。
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③___________ ④(填“>”“<”或“=”)。
(5)25 ℃时,测得HCN和NaCN的混合溶液的pH=11,则 约为
约为___________ 。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为___________ 。
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(2)①中各离子浓度由大到小的顺序是
(3)④的水解平衡常数Kh=
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
(5)25 ℃时,测得HCN和NaCN的混合溶液的pH=11,则
 约为
约为
您最近一年使用:0次
2021-10-20更新
|
1599次组卷
|
13卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系
鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时3 溶液中粒子浓度的大小关系选择性必修1 专题3 第三单元 突破4 溶液中粒子浓度的数量关系(已下线)3.3.1 盐类水解的原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.1 盐溶液的酸碱性及其原因(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第23讲 盐类水解(练) — 2022年高考化学一轮复习讲练测(新教材新高考)黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高二10月月考化学试题(已下线)专题26 盐类的水解(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)周末培优3 盐类的水解-2021-2022学年高二化学课后培优练(人教版选修4)安徽省皖北2022~2023学年高二上学期12月联考化学试题福建省宁德市2022-2023学年高二上学期期末居家检测化学试题江西省部分学校2023-2024学年高二上学期11月期中联考化学试题
2021高一·全国·专题练习
解题方法
7 . 写出下列物质在水中的电离方程式:
(1)硝酸:___________
(2)醋酸:___________
(3)一水合氨:___________
(4)碳酸氢钠:___________
(5)NH4NO3:___________
(6)Al2(SO4)3:___________
(7)Fe(OH)3:___________
(8)H2S:___________
(1)硝酸:
(2)醋酸:
(3)一水合氨:
(4)碳酸氢钠:
(5)NH4NO3:
(6)Al2(SO4)3:
(7)Fe(OH)3:
(8)H2S:
您最近一年使用:0次
8 . 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
探究浓度对醋酸电离程度的影响:用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
回答下列问题:
(1)若用pH试纸测醋酸的pH,实验操作为:_______ 。
(2)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:_______ 。
(3)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度_______ (填增大、减小或不变)
(4) 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性(忽略第二步水解),已知25℃时,
水解而使其水溶液呈碱性(忽略第二步水解),已知25℃时,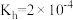 ,则当溶液中
,则当溶液中 时,溶液的pH=
时,溶液的pH=_______ 。
探究浓度对醋酸电离程度的影响:用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 | |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)若用pH试纸测醋酸的pH,实验操作为:
(2)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:
(3)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
(4)
 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性(忽略第二步水解),已知25℃时,
水解而使其水溶液呈碱性(忽略第二步水解),已知25℃时,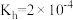 ,则当溶液中
,则当溶液中 时,溶液的pH=
时,溶液的pH=
您最近一年使用:0次
9 . 请回答下列问题:
Ⅰ.已知水的电离平衡曲线如图示,试回答下列问题:

(1)在100℃时,Kw表达式为___________ ,在此温度下,Kw为___________ 。
(2)在室温下,将pH=12的Ba(OH)2溶液与pH=2的稀盐酸混合,欲使混合溶液pH=3,忽略两溶液混合时的体积变化,则Ba(OH)2与盐酸的体积比为___________ 。
(3)室温时将pH为4的硫酸溶液稀释10000倍,稀释后溶液中,c(SO )和c(H+)之比约为
)和c(H+)之比约为___________ 。
Ⅱ.今有①CH3COOH②HCl③H2SO4三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式___________ 。
(5)当它们pH相同时,其物质的量浓度由大到小的顺序为___________ (填序号)。
(6)当它们的物质的量浓度相同时,其溶液中水电离出的c(OH-)由大到小的顺序为___________ (填序号)。
(7)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___________ (填序号)。
Ⅰ.已知水的电离平衡曲线如图示,试回答下列问题:

(1)在100℃时,Kw表达式为
(2)在室温下,将pH=12的Ba(OH)2溶液与pH=2的稀盐酸混合,欲使混合溶液pH=3,忽略两溶液混合时的体积变化,则Ba(OH)2与盐酸的体积比为
(3)室温时将pH为4的硫酸溶液稀释10000倍,稀释后溶液中,c(SO
 )和c(H+)之比约为
)和c(H+)之比约为Ⅱ.今有①CH3COOH②HCl③H2SO4三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式
(5)当它们pH相同时,其物质的量浓度由大到小的顺序为
(6)当它们的物质的量浓度相同时,其溶液中水电离出的c(OH-)由大到小的顺序为
(7)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为
您最近一年使用:0次
10 . 已知25 ℃时,电离平衡常数:
回答下列问题:
(1)下列四种物质电离出质子的能力由大到小的顺序是___________ (填标号)。
a.HCO3- b.HClO c.CH3COOH d.H2CO3
(2)下列反应不能发生的是___________。
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________。
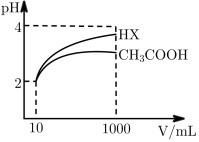
(4)体积为10 mL、pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程pH变化如图,则HX的电离平衡常数___________ (填“大于”“小于”或“等于”,下同)醋酸的电离平衡常数,稀释后,HX溶液中水电离出来的c(H+)___________ 醋酸溶液中水电离出来的c(H+)。
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
回答下列问题:
(1)下列四种物质电离出质子的能力由大到小的顺序是
a.HCO3- b.HClO c.CH3COOH d.H2CO3
(2)下列反应不能发生的是___________。
A. |
| B.ClO-+CH3COOH=CH3COO-+HClO |
C.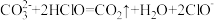 |
D.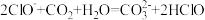 |
A. | B. | C. | D. |

您最近一年使用:0次
2021-09-11更新
|
889次组卷
|
3卷引用:3.1.2 电离平衡常数(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.1.2 电离平衡常数(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河北省张家口市第一中学2020-2021学年高二上学期10月月考(普实班) 化学试题湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题




