名校
1 . 已知:pOH=-lg c(OH-),298K时,向20.00mL0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
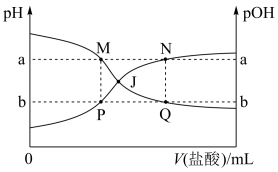

| A.曲线PJN表示溶液中pH的变化 |
| B.M点水的电离程度比N点大 |
| C.M、P两点的数值之和a+b=14 |
| D.pH与pOH交叉点J对应的V(盐酸)=20.00mL |
您最近一年使用:0次
2021-12-05更新
|
584次组卷
|
2卷引用:四川省绵阳东辰国际学校2021-2022学年高二上学期第二次月考化学试题
解题方法
2 . 25℃时,在①pH=2的盐酸、②pH=3的醋酸、③pH=12的氨水、④pH=12的NaOH、⑤pH=4的NH4Cl溶液、⑥pH=12的CH3COONa溶液。6种溶液中,由水电离出的c(H+)大小关系(或顺序)是___ 。
您最近一年使用:0次
名校
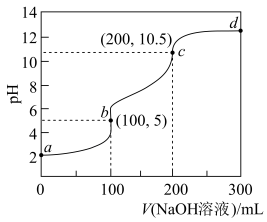
3 . 室温下,向V mL  的二元弱酸
的二元弱酸 溶液中滴加
溶液中滴加 NaOH溶液,溶液的pH随NaOH溶液体积的变化曲线如下图所示。下列有关说法正确的是
NaOH溶液,溶液的pH随NaOH溶液体积的变化曲线如下图所示。下列有关说法正确的是
 的二元弱酸
的二元弱酸 溶液中滴加
溶液中滴加 NaOH溶液,溶液的pH随NaOH溶液体积的变化曲线如下图所示。下列有关说法正确的是
NaOH溶液,溶液的pH随NaOH溶液体积的变化曲线如下图所示。下列有关说法正确的是
| A.a→d的过程中,水的电离程度一直增大 |
B.选择酚酞作指示剂,滴定终点时,只有反应 发生 发生 |
C.加入NaOH溶液50 mL,混合溶液中: |
D.加入NaoH溶液150 mL,混合溶液中: |
您最近一年使用:0次
2021-11-27更新
|
826次组卷
|
4卷引用:重庆市巴蜀中学2021-2022学年高二上期期中考试化学试题
名校
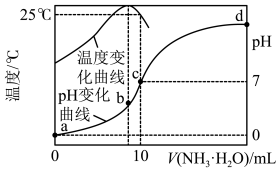
4 . 在某温度时,将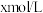 氨水滴入
氨水滴入
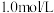 盐酸中,溶液
盐酸中,溶液 和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
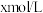 氨水滴入
氨水滴入
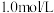 盐酸中,溶液
盐酸中,溶液 和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
A.a点: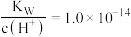 |
B.氨水的浓度为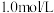 |
C.b点溶液中加入 溶液至中性后, 溶液至中性后,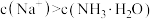 |
D.b、c、d三点水的电离程度大小关系是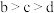 |
您最近一年使用:0次
2021-11-26更新
|
660次组卷
|
4卷引用:上海市复旦大学附属中学2021-2022学年高三上学期期中考试化学试题
解题方法
5 . 已知水的电离平衡曲线如图所示,下列说法中正确的是
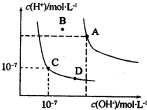

| A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) |
| B.恒温下向水中加入氢氧化钠固体,可从C点到D点 |
| C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合后所得溶液的pH=7 |
| D.温度升高可实现由C点到D点 |
您最近一年使用:0次
名校
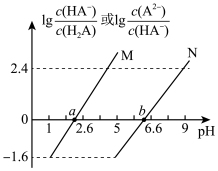
6 . 常温下将NaOH溶液滴加到 溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为
溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为 或
或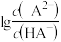 ]下列叙述错误的是
]下列叙述错误的是
 溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为
溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为 或
或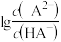 ]下列叙述错误的是
]下列叙述错误的是
A.曲线M表示pH与 的关系 的关系 |
B.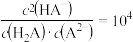 |
C.b点对应溶液中: |
| D.溶液pH从2.6到6.6的过程中,水的电离程度先增大后减小 |
您最近一年使用:0次
2021-11-19更新
|
815次组卷
|
3卷引用:四川省成都市石室中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
7 . 利用烟道气中的 生产
生产 晶体的工艺流程如下所示。下列说法错误的是
晶体的工艺流程如下所示。下列说法错误的是
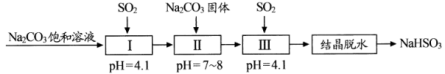
 生产
生产 晶体的工艺流程如下所示。下列说法错误的是
晶体的工艺流程如下所示。下列说法错误的是
A. 时,步骤Ⅰ中溶液为 时,步骤Ⅰ中溶液为 溶液 溶液 |
B.步骤Ⅲ所得溶液中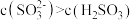 |
C.向 饱和溶液中通入 饱和溶液中通入 的过程,水的电离程度先增大后减小 的过程,水的电离程度先增大后减小 |
D.步骤Ⅱ中发生的反应之一为: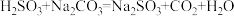 ,则 ,则 的 的 大于 大于 的 的 |
您最近一年使用:0次
名校
8 . 常温下,向20 mL某浓度的硫酸中滴入0.1 mol/L氨水,溶液中水电离出的氢离子的浓度随加入氨水的体积变化如图所示。下列说法正确的是


| A.V=20 |
B.b点所示溶液中:c( )=2c( )=2c( ) ) |
| C.c点所示溶液中:c(H+)-c(OH-)=c(NH3∙H2O) |
| D.该硫酸的浓度为0.1 mol/L |
您最近一年使用:0次
2021-11-17更新
|
112次组卷
|
2卷引用:河北省石家庄市石家庄二中教育集团2021-2022学年高一上学期期中考试化学试题
9 . 电解质溶液电导率越大导电能力越强。根据溶液电导率变化可以确定滴定反应的终点。常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
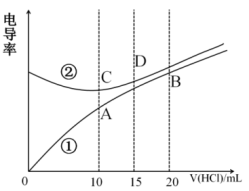

| A.曲线②代表滴定氢氧化钠溶液的曲线 |
| B.滴定二甲胺的过程应该选择甲基橙作为指示剂 |
C.B点溶液中:c(H+)<c(OH-)+c[(CH3)2NH ]+2c[(CH3)2NH] ]+2c[(CH3)2NH] |
| D.A、B、C、D四点的溶液中,水的电离程度最大的是A |
您最近一年使用:0次
名校
解题方法
10 . 25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的无色溶液中:Na+、Cu2+、Cl-、 |
B.使酚酞呈红色的溶液中:K+、Na+、 、Cl- 、Cl- |
C.0.1mol·L-1的FeCl2溶液中:H+、Al3+、 、ClO- 、ClO- |
D.由水电离出的c(H+)=1×10-10mol·L-1的溶液中:Mg2+、 、 、 、 、 |
您最近一年使用:0次
2021-10-11更新
|
1200次组卷
|
2卷引用:河南宋基信阳实验中学2021-2022学年 高三上学期10月月考化学试题



