名校
解题方法
1 . 室温时,向20mL0.1mol/L的两种酸HA、HB中分别滴加0.1mol/LNaOH 溶液,其pH变化分别对应下图中的I、Ⅱ。下列说法不正确的是


| A.向NaA溶液中滴加HB可产生HA |
| B.a点,溶液中微粒浓度:c(A-)>c(Na+)>c(HA) |
| C.滴加20mLNaOH溶液时,I中H2O的电离程度大于Ⅱ中 |
| D.滴加NaOH溶液至pH=7时,两种溶液中c(A-)=c(B-) |
您最近一年使用:0次
2 . 常温下,将 溶液滴加到
溶液滴加到 等浓度的某一元酸HA溶液中,测得混合溶液的pH与粒子浓度比值的负对数的变化关系如图所示下列叙述不正确的是
等浓度的某一元酸HA溶液中,测得混合溶液的pH与粒子浓度比值的负对数的变化关系如图所示下列叙述不正确的是
 溶液滴加到
溶液滴加到 等浓度的某一元酸HA溶液中,测得混合溶液的pH与粒子浓度比值的负对数的变化关系如图所示下列叙述不正确的是
等浓度的某一元酸HA溶液中,测得混合溶液的pH与粒子浓度比值的负对数的变化关系如图所示下列叙述不正确的是
A.m点对应的 溶液体积小于 溶液体积小于 |
B. 的数量级为 的数量级为 |
C.l点所示溶液中: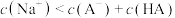 |
D.各点的水溶液中水的电离程度大小关系: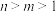 |
您最近一年使用:0次
2023-12-27更新
|
431次组卷
|
8卷引用:湖北省孝感市孝感高级中学2021届高三2月调研考试化学试题
湖北省孝感市孝感高级中学2021届高三2月调研考试化学试题(已下线)学科网2021年高三3月大联考考后强化卷(新课标Ⅲ卷)(已下线)学科网2021年高三3月大联考考后强化卷(新课标Ⅰ卷)江西省南昌市第十中学2021届高三下学期第一次月考化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题内蒙古赤峰二中2023-2024学年高三上学期第四次月考化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河北省保定市高碑店市崇德实验中学2023-2024学年高二上学期1月考试化学试题
解题方法
3 . 室温下,向10mL0.1mol·L-1HA溶液中滴加0.1mol·L-1的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:AG=lg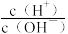 。
。
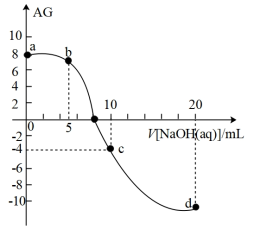
下列说法错误的是
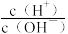 。
。
下列说法错误的是
| A.在a、b、c、d点对应的溶液中,c点时水的电离程度最大 |
| B.b点对应的溶液中:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C.d点对应的溶液中:c(OH-)=c(H+)+c(HA)+c(A-) |
| D.室温下,HA的电离常数Ka约为1.0×10-4 |
您最近一年使用:0次
2022-04-30更新
|
352次组卷
|
3卷引用:河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题
河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题广东省韶关市2021-2022学年高三上学期期中考试化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)
名校
4 . 下列图示与对应的叙述不相符的是
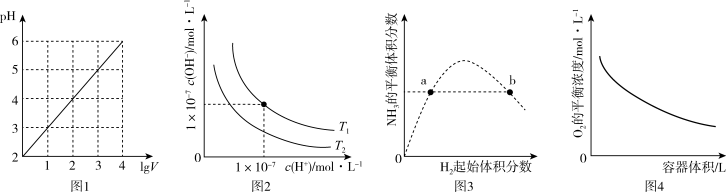
| A.图1表示1LpH=2的HCl溶液加水稀释至VL,pH随lgV的变化 |
| B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T1>T2 |
| C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 |
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
您最近一年使用:0次
2022-04-04更新
|
748次组卷
|
3卷引用:黑龙江省鸡西市一中2021-2022学年高二上学期期中考试化学试题
名校
解题方法
5 . 25℃时,用0.1 mol∙L−1的KOH溶液滴定10mL等浓度的一元弱酸HX溶液过程中,溶液中的lg  随滴入KOH溶液体积的变化关系如图所示。下列说法正确的是
随滴入KOH溶液体积的变化关系如图所示。下列说法正确的是

 随滴入KOH溶液体积的变化关系如图所示。下列说法正确的是
随滴入KOH溶液体积的变化关系如图所示。下列说法正确的是
| A.一元弱酸HX的电离常数约为10−5 |
| B.若b点为15mL,此溶液中存在:3c(K+)=2 c(X-)+2 c(HX) |
| C.从a点到c点过程中水的电离程度先减小后增大 |
| D.a点溶液中存在:c(K+)> c(X-)> c(H+)= c(OH-) |
您最近一年使用:0次
2022-02-20更新
|
261次组卷
|
3卷引用:四川省内江市第六中学2021-2022学年高三上学期第四次月考化学试题
四川省内江市第六中学2021-2022学年高三上学期第四次月考化学试题 湖南省株洲市第八中学2022-2023学年高三上学期第三次月考化学试题(已下线)2023年湖南卷高考真题变式题(选择题11-14)
名校
6 . 25℃,向100mL0.01mol·L-1的NaHA溶液中分别加入浓度均为0.01mol·L-1的NaOH溶液和盐酸,混合溶液的pH随所加溶液体积的变化关系如图所示(lg5=0.7)。下列说法不正确的是


| A.25℃,H2A的第二步电离平衡常数约为10-6 |
| B.P点时溶液中存在:2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-) |
| C.水的电离程度为N>M>P |
| D.随着盐酸的不断滴入,最终溶液的pH可能小于2 |
您最近一年使用:0次
名校
7 . H2A为二元酸,其电离过程为:H2A H++HA-,HA-
H++HA-,HA- H++A2-。常温时,向10mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
H++A2-。常温时,向10mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
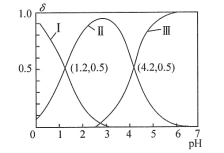
 H++HA-,HA-
H++HA-,HA- H++A2-。常温时,向10mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
H++A2-。常温时,向10mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
| A.H2A的Kal的数量级为10-1 |
| B.当溶液中c(H2A)=c(A2-)时,pH=2.9 |
| C.当溶液中c(Na+)=2c(A2-)+c(HA-)时,加入V(NaOH溶液)>10mL |
| D.常温下NaHA能促进水的电离 |
您最近一年使用:0次
8 . 25℃时,将浓度均为0.1 的HA溶液和BOH溶液按体积分别为
的HA溶液和BOH溶液按体积分别为 和
和 混合,保持
混合,保持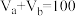 mL,已知BA可溶于水,
mL,已知BA可溶于水, 、
、 与混合液pH关系如图。下列说法正确的是
与混合液pH关系如图。下列说法正确的是

 的HA溶液和BOH溶液按体积分别为
的HA溶液和BOH溶液按体积分别为 和
和 混合,保持
混合,保持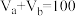 mL,已知BA可溶于水,
mL,已知BA可溶于水, 、
、 与混合液pH关系如图。下列说法正确的是
与混合液pH关系如图。下列说法正确的是
A.BOH的电离常数 约为 约为 |
B.x点溶液: |
C.y点溶液: |
| D.水的电离程度:z点>y点 |
您最近一年使用:0次
2021-12-30更新
|
435次组卷
|
2卷引用:辽宁省名校2021-2022学年高三上学期第五次联合考试化学试题
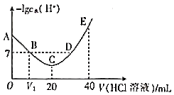
9 . 羟胺的电离方程式: (25℃时,
(25℃时, )。用0.1mol/L的盐酸滴定
)。用0.1mol/L的盐酸滴定 羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的
羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的 浓度的负对数与盐酸体积的关系如图所示(已知:
浓度的负对数与盐酸体积的关系如图所示(已知: )。下列说法错误的是
)。下列说法错误的是
 (25℃时,
(25℃时, )。用0.1mol/L的盐酸滴定
)。用0.1mol/L的盐酸滴定 羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的
羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的 浓度的负对数与盐酸体积的关系如图所示(已知:
浓度的负对数与盐酸体积的关系如图所示(已知: )。下列说法错误的是
)。下列说法错误的是
A.图中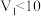 |
B.A点对应溶液的 |
| C.B、D两点对应的溶液的pH相等 |
D.C点对应溶液中存在: |
您最近一年使用:0次
10 . 25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka___________ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________ (填字母)。
a.CO b.ClO— c.CH3COO— d.HCO
b.ClO— c.CH3COO— d.HCO
(3)下列反应不能发生的是___________ (填字母)。
a. CO +2CH3COOH=2CH3COO—+CO2↑+H2O b. ClO—+CH3COOH=CH3COO—+HClOc. CO
+2CH3COOH=2CH3COO—+CO2↑+H2O b. ClO—+CH3COOH=CH3COO—+HClOc. CO +2HClO=CO2↑+H2O+2ClO—d. 2ClO—+CO2+H2O=CO
+2HClO=CO2↑+H2O+2ClO—d. 2ClO—+CO2+H2O=CO +2HClO
+2HClO
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是___________ (填字母)。
a. b.
b.  c.
c.  d.
d.
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。则HX的电离平衡常数___________ (填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)___________ 醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸___________ HX。

(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO—)—c(Na+)=___________ mol·L-1(填精确数值)。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a.CO
 b.ClO— c.CH3COO— d.HCO
b.ClO— c.CH3COO— d.HCO
(3)下列反应不能发生的是
a. CO
 +2CH3COOH=2CH3COO—+CO2↑+H2O b. ClO—+CH3COOH=CH3COO—+HClOc. CO
+2CH3COOH=2CH3COO—+CO2↑+H2O b. ClO—+CH3COOH=CH3COO—+HClOc. CO +2HClO=CO2↑+H2O+2ClO—d. 2ClO—+CO2+H2O=CO
+2HClO=CO2↑+H2O+2ClO—d. 2ClO—+CO2+H2O=CO +2HClO
+2HClO(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是
a.
 b.
b.  c.
c.  d.
d.
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。则HX的电离平衡常数

(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO—)—c(Na+)=
您最近一年使用:0次



