名校
解题方法
1 . 苯甲酸是一种重要的化工产品,在25℃和95℃下在水中的溶解度分别为0.3 g和6.9 g。实验室制备苯甲酸并测定其纯度的步骤如下:
I.苯甲酸的制备
量取一定量的甲苯和足量
 溶液发生反应:
溶液发生反应: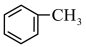 +2KMnO4
+2KMnO4
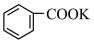 +KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
+KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
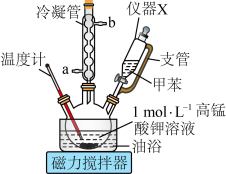
(1)仪器X的名称为_______ ,冷凝管的出水口为_______ (填“a”或“b”)。
(2)三颈烧瓶中反应基本完成的现象为_______ ,用油浴加热的优点是_______ 。
(3)“滤渣”的主要成分为_______ (填化学式);每得到1 mol滤渣,理论上转移的电子的物质的量为_______ mol。
(4)酸化时,_______ (填“能”或“不能”)用冰醋酸代替浓硫酸,理由是_______ 。
II.纯度测定
(5)称取0.10 g样品,溶于15 mL NaOH溶液中,加入2滴酚酞作指示剂,用
NaOH溶液中,加入2滴酚酞作指示剂,用 盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用
盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用 盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为_______ ,若第二次滴定过程中,滴定管起始有气泡,滴定终点时气泡消失,则导致所测得样品中苯甲酸的纯度_______ (填“偏高”、“偏低”或“不变”)。
I.苯甲酸的制备
量取一定量的甲苯和足量

 溶液发生反应:
溶液发生反应: +2KMnO4
+2KMnO4
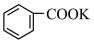 +KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
+KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
(1)仪器X的名称为
(2)三颈烧瓶中反应基本完成的现象为
(3)“滤渣”的主要成分为
(4)酸化时,
II.纯度测定
(5)称取0.10 g样品,溶于15 mL
 NaOH溶液中,加入2滴酚酞作指示剂,用
NaOH溶液中,加入2滴酚酞作指示剂,用 盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用
盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用 盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
您最近一年使用:0次
2023-01-14更新
|
177次组卷
|
3卷引用:云南省开远市第一中学校2022-2023学年高二下学期4月月考化学试题
2 . 实验室有一瓶未知浓度的Na2S2O3溶液,通过下列实验测定其浓度。
①取10.00 mL Na2S2O3溶液于锥形瓶中,滴入2~3滴指示剂。
②取一滴定管,依次查漏,洗涤,用0.01 mol·L-1的I2标准溶液润洗,然后注入该标准溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为 I2+2Na2S2O3=2NaI+Na2S4O6。
请回答下列问题:
(1)步骤①加入的指示剂是_______ ;装I2标准溶液用_______ 滴定管。
(2)步骤③达到滴定终点的判断:_______
(3)已知消耗标准液的实验数据如下表:
则废水中的Na2S2O3的物质的量浓度为_______
(4)下列操作会导致测定结果偏高的是_______(填字号)
①取10.00 mL Na2S2O3溶液于锥形瓶中,滴入2~3滴指示剂。
②取一滴定管,依次查漏,洗涤,用0.01 mol·L-1的I2标准溶液润洗,然后注入该标准溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为 I2+2Na2S2O3=2NaI+Na2S4O6。
请回答下列问题:
(1)步骤①加入的指示剂是
(2)步骤③达到滴定终点的判断:
(3)已知消耗标准液的实验数据如下表:
| 实验次数 | 开始读数/mL | 结束读数/mL |
| 1 | 0.10 | 19.20 |
| 2 | 1.85 | 20.75 |
| 3 | 0.00 | 24.06 |
(4)下列操作会导致测定结果偏高的是_______(填字号)
| A.滴定管在装液前未用标准溶液润洗 |
| B.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出 |
| C.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 |
| D.达到滴定终点时,仰视读数 |
您最近一年使用:0次
2022-12-11更新
|
110次组卷
|
2卷引用:云南衡水实验中学2021-2022学年高二上学期期末考试化学试题
解题方法
3 . 现用物质的量浓度为amol•L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,选择酚酞做指示剂。请填写下列空白:
(1))碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是____ 。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入如图的____ (填“甲”或“乙”)中。进行滴定操作时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视_____ 。

(3)如图是碱式滴定管中液面在滴定前后的读数,则c(HCl)=____ mol•L-1。

(4)滴定到终点的现象是____ 。
(5)下列操作中,可能使所测盐酸的浓度数值偏低的是____ (填字母)。
(1))碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入如图的

(3)如图是碱式滴定管中液面在滴定前后的读数,则c(HCl)=

(4)滴定到终点的现象是
(5)下列操作中,可能使所测盐酸的浓度数值偏低的是
| A.碱滴定管未用标准氢氧化钠润洗就直接注入标准氢氧化钠 |
| B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.碱式定管在滴定前有气泡,滴定后气泡消失 |
| D.读取氢氧化钠体积时,开始仰视读数,滴定结束时俯视读数 |
您最近一年使用:0次
2022-09-22更新
|
129次组卷
|
2卷引用:云南省昆明师范专科学校附属中学2021-2022学年高二上学期期末考试化学试题
4 . 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用_______ 式滴定管盛装0.1000 mol•L-1盐酸标准液。配制250 mL0.1000 mol•L-1盐酸标准液,必须使用的容器,除了烧杯、玻璃棒、量筒、胶头滴管外,还需要_______ 。
(2)量取NaOH待测液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的_______ 操作。(填“甲”、“乙”、“丙”)。

(3)有关数据记录如下:
滴定过程中,眼睛应注视_______ ,第二次滴定前后50 mL滴定管中液面的位置如图所示,该次滴定所消耗标准盐酸体积为_______ mL。

(4)该实验应选用_______ (填“酚酞”或者“石蕊”)作指示剂;到达滴定终点的现象是_______ 。
(5)根据所给数据,该烧碱样品的物质的量浓度为_______ mol/L(保留四位有效数字)。
(6)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______。
(7)硒是人体所需微量元素之一,也是一种重要的工业原料。Na2S2O3可以用于测定粗硒中硒的含量,操作步骤如下:
①用浓H2SO4将样品中的Se氧化为SeO2;
②用KI溶液还原SeO2为Se,同时生成I2;
③加入指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2S2O =2I-+S4O
=2I-+S4O )。实验中准确称量0.4000 g粗硒样品,滴定中消耗0.8000 mol·L-1的Na2S2O3溶液20.00 mL。
)。实验中准确称量0.4000 g粗硒样品,滴定中消耗0.8000 mol·L-1的Na2S2O3溶液20.00 mL。
加入的指示剂为_______ ,粗硒样品中硒的质量分数为_______ 。
(1)用
(2)量取NaOH待测液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的

(3)有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |

(4)该实验应选用
(5)根据所给数据,该烧碱样品的物质的量浓度为
(6)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______。
| A.滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.读取盐酸体积时,滴定前读数正确,滴定结束时俯视读数 |
| D.装标准液的滴定管在滴定前有气泡,滴定后气泡消失 |
①用浓H2SO4将样品中的Se氧化为SeO2;
②用KI溶液还原SeO2为Se,同时生成I2;
③加入指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2S2O
 =2I-+S4O
=2I-+S4O )。实验中准确称量0.4000 g粗硒样品,滴定中消耗0.8000 mol·L-1的Na2S2O3溶液20.00 mL。
)。实验中准确称量0.4000 g粗硒样品,滴定中消耗0.8000 mol·L-1的Na2S2O3溶液20.00 mL。加入的指示剂为
您最近一年使用:0次
名校
5 . 草酸(H2C2O4)是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性KMnO4溶液发生反应。请回答下列问题:
(1)探究外界条件对反应速率的影响。
①硫酸酸化的高锰酸钾溶液与草酸溶液反应的离子方程式为_______ 。
②完成此实验设计,其中:V1=_______ ,V2=_______ 。
③对比实验1、2可探究_______ 对反应速率的影响。
(2)利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取100 mL的血液样品,加入足量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于足量强酸可得草酸溶液,然后用0.01 mol·L-1的酸性KMnO4标准溶液滴定草酸溶液,根据消耗酸性KMnO4标准溶液的体积即可测定血液样品中Ca2+的物质的量浓度。
①如何判断滴定终点:_______ 。
②若消耗的酸性KMnO4标准溶液为9.60 mL,则该血液样品中Ca2+的物质的量浓度_______ mmol·L-1。
③下列操作会使测得的血液样品中Ca2+的物质的量浓度偏高的是_______ 。
A.草酸钙(CaC2O4)沉淀洗涤不充分 B.滴定管未用标准溶液润洗
C.滴定前仰视读数,结束时俯视读数 D.滴定过程中少量液体溅到锥形瓶外
(1)探究外界条件对反应速率的影响。
| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
| 0.01 mol·L-1H2C2O4溶液 | 0.01 mol·L-1KMnO4溶液 | 3.0 mol·L-1稀H2SO4 | 水 | 温度/℃ | ||
| 1 | 12.0 | 2.0 | 3.0 | 3.0 | 20 | t1 |
| 2 | 6.0 | 2.0 | 3.0 | V1 | 20 | t2 |
| 3 | V2 | 2.0 | 3.0 | 9.0 | 30 | t3 |
②完成此实验设计,其中:V1=
③对比实验1、2可探究
(2)利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取100 mL的血液样品,加入足量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于足量强酸可得草酸溶液,然后用0.01 mol·L-1的酸性KMnO4标准溶液滴定草酸溶液,根据消耗酸性KMnO4标准溶液的体积即可测定血液样品中Ca2+的物质的量浓度。
①如何判断滴定终点:
②若消耗的酸性KMnO4标准溶液为9.60 mL,则该血液样品中Ca2+的物质的量浓度
③下列操作会使测得的血液样品中Ca2+的物质的量浓度偏高的是
A.草酸钙(CaC2O4)沉淀洗涤不充分 B.滴定管未用标准溶液润洗
C.滴定前仰视读数,结束时俯视读数 D.滴定过程中少量液体溅到锥形瓶外
您最近一年使用:0次
2022-05-29更新
|
208次组卷
|
3卷引用:云南省昆明市第三中学、滇池中学2021-2022学年高二下学期期中考试化学试题
名校
6 . 某兴趣小组对NaOH溶液和稀盐酸混合后的有关问题进行了如下探究:
查阅资料:如表是实验室里盐酸、NaOH试剂瓶标签上的部分说明:
实验探究:
(1)配制溶液:甲同学配制100mL1.5mol·L-1NaOH溶液,乙同学取20mL36.5%的盐酸稀释到200mL。甲为了证明NaOH溶液与稀盐酸能发生化学反应,设计并完成了如图所示的实验。
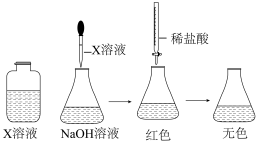
X溶液滴入的量一般为____ ,使用酸式滴定管前要检查活塞是否漏水的操作方法是____ 。
(2)乙设计完成了另一个实验,以证明NaOH溶液与盐酸能够发生反应。他在盛有20mL稀盐酸的锥形瓶里,用碱式滴定管滴入NaOH溶液,不断振荡溶液,同时用pH计测定溶液的pH,直到NaOH溶液过量。则在滴定过程中,滴定终点附近的操作是____ 。
(3)你认为甲、乙两位同学的实验中,____ (填“甲”、“乙”或“甲和乙”)的实验能充分证明NaOH与盐酸发生了反应。
(4)丙同学为了测定上述36.5%盐酸的物质的量浓度,进行了如下实验:在锥形瓶中加入已稀释的盐酸,用碱式滴定管滴入甲配制的NaOH溶液,测定的结果如表:
据此通过计算可知实验测定的盐酸浓度与标签说明的浓度相比____ (填“偏高”、“偏低”或“相等”)。
查阅资料:如表是实验室里盐酸、NaOH试剂瓶标签上的部分说明:
| 化学式 | 相对分子质量 | ||
| 盐酸 | HCl | 36.5 | 密度:1.20g·mL-1,质量分数:36.5%,无色易挥发 |
| 氢氧化钠 | NaOH | 40 | 俗名:烧碱、火碱、苛性钠,易潮解的固体 |
(1)配制溶液:甲同学配制100mL1.5mol·L-1NaOH溶液,乙同学取20mL36.5%的盐酸稀释到200mL。甲为了证明NaOH溶液与稀盐酸能发生化学反应,设计并完成了如图所示的实验。

X溶液滴入的量一般为
(2)乙设计完成了另一个实验,以证明NaOH溶液与盐酸能够发生反应。他在盛有20mL稀盐酸的锥形瓶里,用碱式滴定管滴入NaOH溶液,不断振荡溶液,同时用pH计测定溶液的pH,直到NaOH溶液过量。则在滴定过程中,滴定终点附近的操作是
(3)你认为甲、乙两位同学的实验中,
(4)丙同学为了测定上述36.5%盐酸的物质的量浓度,进行了如下实验:在锥形瓶中加入已稀释的盐酸,用碱式滴定管滴入甲配制的NaOH溶液,测定的结果如表:
| 测定次数 | 盐酸的体积/mL | 氢氧化钠溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
您最近一年使用:0次
名校
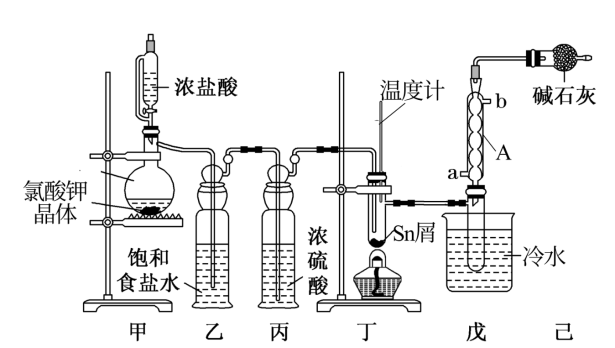
7 . FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等,实验室可用无水四氯化锡(SnCl4)制作FTO,制备SnCl4的装置如图所示。
有关信息如表:
(1)仪器A的名称为___ ,甲中发生反应的离子方程式为___ 。
(2)将如图装置连接好,先检查装置的气密性,再慢慢滴入浓盐酸,待观察到___ 现象后,开始加热装置丁。
(3)Cl2和Sn的反应产物可能会有SnCl4和SnCl2,为加快反应速率并防止产品中带入SnCl2,除了通入过量氯气外,应控制的最佳温度在___ (填序号)范围内。
(4)为测定产品中Sn2+的含量,甲、乙两位同学设计了如下实验方案:
①甲同学:准确称取m g产品于锥形瓶中,用蒸馏水溶解,用a mol/L酸性高锰酸钾标准溶液滴定,滴定终点时消耗酸性高锰酸钾标准溶液V1 mL。由此可计算产品中Sn2+的质量分数。乙同学认为甲同学的方案明显不合理,会导致测得的Sn2+的质量分数严重偏高,理由是___ 。
②乙同学:准确称取m g产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L。硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V2 mL,由此可计算产品中Sn2+的质量分数。硝酸银溶液最好盛放在___ (填序号)滴定管中。
A.无色酸式滴定管 B.棕色酸式滴定管 C.无色碱式滴定管 D.棕色碱式滴定管
参考表中的数据,X溶液最好选用的是___ (填序号)。
A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D.Na2CrO4溶液
滴定终点的现象为___ 。甲同学认为乙同学的方案中用V2 mL进行计算不准确,理由是___ 。

有关信息如表:
| 化学式 | Sn | SnCl2 | SnCl4 |
| 熔点/℃ | 232 | 246 | -33 |
| 沸点/℃ | 2260 | 652 | 114 |
| 其他性质 | 银白色固体金属 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易水解生成 SnO2·xH2O |
(2)将如图装置连接好,先检查装置的气密性,再慢慢滴入浓盐酸,待观察到
(3)Cl2和Sn的反应产物可能会有SnCl4和SnCl2,为加快反应速率并防止产品中带入SnCl2,除了通入过量氯气外,应控制的最佳温度在
| A.652~2260℃ | B.232~652℃ | C.114-246℃ | D.114~232℃ |
①甲同学:准确称取m g产品于锥形瓶中,用蒸馏水溶解,用a mol/L酸性高锰酸钾标准溶液滴定,滴定终点时消耗酸性高锰酸钾标准溶液V1 mL。由此可计算产品中Sn2+的质量分数。乙同学认为甲同学的方案明显不合理,会导致测得的Sn2+的质量分数严重偏高,理由是
②乙同学:准确称取m g产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L。硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V2 mL,由此可计算产品中Sn2+的质量分数。硝酸银溶液最好盛放在
A.无色酸式滴定管 B.棕色酸式滴定管 C.无色碱式滴定管 D.棕色碱式滴定管
参考表中的数据,X溶液最好选用的是
A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D.Na2CrO4溶液
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 白 | 砖红 |
| Ksp | 1.77×10-18 | 5.4×10-14 | 2.7×10-16 | 1.12×10-12 |
您最近一年使用:0次
2022-02-25更新
|
296次组卷
|
3卷引用:云南省昆明市师范大学附属中学2021-2022学年高三 下学期适应性月考卷(八)理科综合化学试题
名校
8 . 酸碱中和滴定是化学中重要的定量实验,某兴趣小组准确量取 待测浓度的盐酸于锥形瓶中,用
待测浓度的盐酸于锥形瓶中,用 的
的 标准溶液滴定。下列说法正确的是
标准溶液滴定。下列说法正确的是
 待测浓度的盐酸于锥形瓶中,用
待测浓度的盐酸于锥形瓶中,用 的
的 标准溶液滴定。下列说法正确的是
标准溶液滴定。下列说法正确的是| A.锥形瓶用蒸馏水洗涤以后,再用待测液润洗 |
| B.使用酚酞为指示剂,当锥形瓶中的溶液由红色变为无色时停止滴定 |
C.实验过程中某同学记录消耗的 溶液的体积为 溶液的体积为 |
D.盛 标准溶液的滴定管尖嘴部分滴定前有气泡,到达滴定终点时气泡消失,则测定结果偏高 标准溶液的滴定管尖嘴部分滴定前有气泡,到达滴定终点时气泡消失,则测定结果偏高 |
您最近一年使用:0次
2022-01-21更新
|
251次组卷
|
6卷引用:云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高二上学期12月月考化学试题
名校
9 . 下列实验误差分析不正确 的是
| A.用标准HCl溶液滴定NH3·H2O溶液来测定其浓度,选择酚酞为指示剂会使浓度偏大 |
| B.中和热测定实验中,用铜制环形搅拌器代替玻璃搅拌器所测放出的热量偏小 |
| C.用润湿的pH试纸测稀NaOH溶液的pH,测定值偏小 |
| D.用酸式滴定管量取20.00mL的盐酸溶液,开始时平视读数,结束时仰视读数,会使所量液体体积偏小 |
您最近一年使用:0次
2021-11-20更新
|
1246次组卷
|
8卷引用:云南省弥勒市第一中学2021-2022学年高二下学期第三次月考化学试题
名校
解题方法
10 . 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制 标准溶液。
标准溶液。
步骤二:取 待测稀盐酸放入锥形瓶中,并滴加
待测稀盐酸放入锥形瓶中,并滴加 滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作
滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作 次,记录数据如下。
次,记录数据如下。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器除烧杯、玻璃棒外还有______ 、_____ 。
(2)如何准确判断滴定终点____ 。
(3)如图某次实验的滴定管中的液面,其读数为_______  。
。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_______ (填字母序号)。
A.配制标准溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
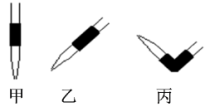
(5)排去碱式滴定管中气泡的方法应采用图的__________ 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(6)从实验所得数据计算,盐酸溶液的浓度为________  。(结果保留到小数点后两位)
。(结果保留到小数点后两位)
步骤一:配制
 标准溶液。
标准溶液。步骤二:取
 待测稀盐酸放入锥形瓶中,并滴加
待测稀盐酸放入锥形瓶中,并滴加 滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作
滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作 次,记录数据如下。
次,记录数据如下。实验编号 | 盐酸溶液 | 滴定管起始读数 | 滴定管滴定终点读数 |
1 | 20.00 | 0.00 | 22.58 |
2 | 20.00 | 0.00 | 22.60 |
3 | 20.00 | 0.00 | 22.62 |
(1)步骤一中要用到的玻璃仪器除烧杯、玻璃棒外还有
(2)如何准确判断滴定终点
(3)如图某次实验的滴定管中的液面,其读数为
 。
。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有
A.配制标准溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(5)排去碱式滴定管中气泡的方法应采用图的

(6)从实验所得数据计算,盐酸溶液的浓度为
 。(结果保留到小数点后两位)
。(结果保留到小数点后两位)
您最近一年使用:0次
2021-11-10更新
|
158次组卷
|
3卷引用:云南省弥勒市第一中学2021-2022学年高二上学期第三次月考化学试题




