i.乙烯可在加热条件下催化氧化制得环氧乙烷(
 );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为
②防冻液在使用一段时间后pH会降低的可能原因为
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2
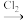
 →CH2OHCH2OH
→CH2OHCH2OH②CH2=CH2→
 →CH2OHCH2OH
→CH2OHCH2OH生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是
(1)NH3极易溶于水且溶液显碱性,请用化学方程式解释原因:
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=
③0.1mol/LNa2N2O2溶液中离子浓度由大到小的顺序为
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ:2NH3(g)+CO2(g)
 NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;反应Ⅲ:H2O(l)=H2O(g) ΔH3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g

①T1℃时,NH3的平衡转化率=
②图2中能正确反应平衡常数K随温度变化关系的曲线为
已知:
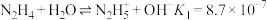 ;
; 。
。有关反应的方程式错误的是
A.羟胺还原 的反应: 的反应: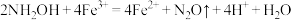 |
B.羟胺分解的反应: |
C.向羟胺溶液中滴加过量稀硫酸: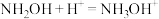 |
D.向(NH4)2SO4溶液中加入NH2OH: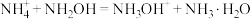 |
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:
②pH=2.2时,溶液c(H2A):c(HA-)=
③0.1 mol∙L−1NaHA溶液显
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=

已知:
①Ce4+能与
 结合成
结合成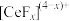 ,也能与
,也能与 结合成
结合成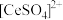 ;
;②Ce3+和Na2SO4形成复盐沉淀,Ce3+在空气中易被氧化为Ce4+;
③硫脲(SCN2H4)具有还原性,酸性条件下易被氧化为(SCN2H3)2。
回答下列问题:
(1)焙烧后,Ce元素转化成CeO2和CeF4,写出焙烧的化学方程式:
(2)滤渣A的主要成分是
(3)步骤①加入稀硫酸浸出,Ce的浸出率与c(H+)、温度的关系如图所示,应选择的适宜的条件为_______(填标号)。
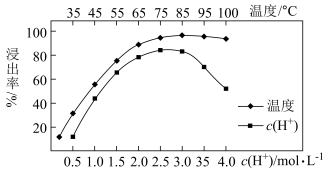
A. | B. | C. | D.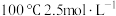 |
(5)CeFCO3在氧化焙烧时会产生一种气体,该气体溶于水后能腐蚀玻璃的原因是
(6)常温下,若步骤④中Ce3+恰好沉淀完全[
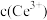 为
为 ,此时测得溶液的pH=5,则溶液中
,此时测得溶液的pH=5,则溶液中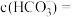
 {已知常温下
{已知常温下 ,
, 。
。
Ⅰ.合成氨工艺是人工固氮的重要途径。
(1)可用作合成氨的催化剂有很多,如Os,Fe,Pt,Mn,Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如图:

注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字单位:eV)其中,TS表示过渡态,*表示吸附态。
①请写出N2参与化学吸附的反应方程式:
②以上历程须克服的最大势垒为
(2)在使用同一催化剂时,将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化(a点恰好达到平衡),曲线B表示T1时n(NH3)的变化。

①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)
②能否由图中数据得出温度T1>T2,并说明理由
Ⅱ.液氨是一种应用广泛的非水溶剂,以氨为原料可以合成很多重要化合物。
(3)Arrhenius提出:溶剂在液态下能自发发生电离,产生溶剂阳离子与溶剂阴离子的现象,称为自耦电离,如液态水的自耦电离方程式为:2H2O
 H3O++OH-。在液氨中也存在类似的自耦电离,试写出液氨中NH4Cl与NaNH2反应的离子方程式:
H3O++OH-。在液氨中也存在类似的自耦电离,试写出液氨中NH4Cl与NaNH2反应的离子方程式:(4)如图是20℃时,NH3—CO2—H2O三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。
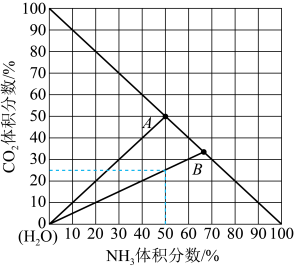
20℃时,可根据需要,选择水溶液体系反应得到(NH4)2CO3(aq)与NH4HCO3(aq),也可选择无水体系反应得到NH4COONH2(s)。
①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq)的最佳曲线是
②B点可得到的产品是
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1
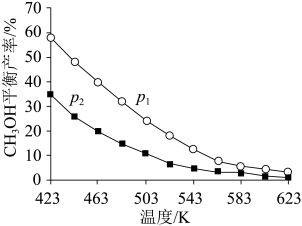
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
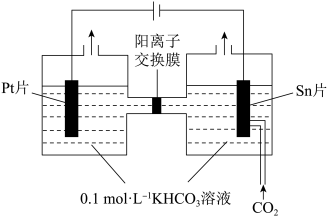
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:
8 . 温室气体的利用是当前环境和能源领域的研究热点。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)→NH2COONH4(s) ΔH1=-159.5 kJ/mol
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.5 kJ/mol
总反应Ⅲ:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=______kJ/mol
①反应Ⅲ的ΔH3=
②一定温度下,在体积固定的密闭容器中将NH3和CO2按2:1投入进行反应合成尿素,下列能说明反应I达到化学平衡状态的是
a.体系内固体质量不改变
b.NH3的物质的量分数不再变化
c.2v正(NH3)=v逆(CO2)
d.容器内混合气体的密度不再变化
(2)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、H2),发生反应为:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH>0,将等物质的量的甲烷和水蒸气投入一个刚性容器中,图中a、b两条曲线代表压强分别为1MPa、2MPa时甲烷平衡含量曲线,其中表示1MPa的是

(3)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如下图所示。过程②的化学方程式是

(4)已知:
表1 25℃时浓度为0.1mol/L两种溶液的pH
溶质 | NaClO | Na2CO3 |
pH | 9.7 | 11.6 |
表2 25℃时两种酸的电离平衡常数
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①根据表1能不能判断出H2CO3与HClO酸性强弱?
②H2SO3溶液和NaHCO3溶液反应的离子方程式为
 是一种廉价的碳资源,其综合利用可以减少碳排放,对保护环境有重要意义。
是一种廉价的碳资源,其综合利用可以减少碳排放,对保护环境有重要意义。(1)碱液吸收。室温下用NaOH溶液捕获
 ,若所得溶液中
,若所得溶液中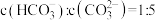 ,则溶液pH=
,则溶液pH= 的电离常数:
的电离常数: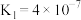
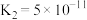 )
)(2)催化转化。以
 、
、 为原料在催化剂作用下合成
为原料在催化剂作用下合成 涉及的主要反应如下。
涉及的主要反应如下。Ⅰ.

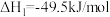
Ⅱ.

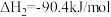
Ⅲ.


回答下列问题:
①

②反应Ⅱ的反应历程如下图,其中吸附在催化剂表面上的物种用*标注。
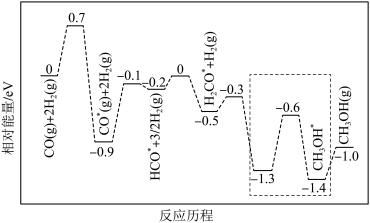
该反应历程中决速步的能垒为
③不同压强下,按照
 投料,实验测定
投料,实验测定 的平衡转化率(X)随温度(T)的变化关系如图所示。
的平衡转化率(X)随温度(T)的变化关系如图所示。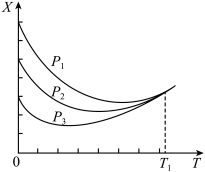
压强
 、
、 、
、 由大到小的顺序为
由大到小的顺序为 时,X几乎相等的原因是
时,X几乎相等的原因是(3)250℃,一定压强和催化剂条件下,1.32mol
 和3.96mol
和3.96mol 充分反应,平衡时CO为0.03mol,
充分反应,平衡时CO为0.03mol, 为0.41mol,试求反应Ⅲ的平衡常数
为0.41mol,试求反应Ⅲ的平衡常数(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)b物质一极的电极反应式
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为



