
(1)上述流程中循环使用的物质有
(2)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2+H2O
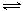 HOCH2CH2NH3++OH-,写出足量乙醇胺吸收SO2的化学方程式
HOCH2CH2NH3++OH-,写出足量乙醇胺吸收SO2的化学方程式(3)写出吸收池Ⅲ中,酸性条件下NO转化为NO3-的离子方程式为
(4)向吸收池Ⅳ得到的HSO3﹣溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,运用平衡移动原理解释溶液pH降低的原因:
(5)电解池Ⅴ可使Ce4+再生,装置如下图所示:

生成Ce4+从
(6)从氧化池Ⅵ中得到粗产品NH4NO3晶体,采用加热蒸干的方法是否合理
反应1(热裂解):

反应2(脱羧基):

(1)
 中形成
中形成

 。
。(2)向一恒容密闭容器中充入一定量的乙酸气体发生反应1和反应2,反应相同时间后,测得部分气体产率与温度的关系如图。

 之后氢气产率高于甲烷,试说明理由:
之后氢气产率高于甲烷,试说明理由:②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而
 产率下降,分析可能原因:
产率下降,分析可能原因:(3)采用光催化反应技术直接合成乙酸,可符合原子经济学(原子利用率100%)。下列原料组合符合要求的是
A.
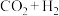 B.
B.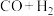 C.
C.
(4)若利用合适的催化剂控制其他副反应(只发生反应1和反应2),温度为
 时反应达到平衡,此时总压强为力
时反应达到平衡,此时总压强为力 ,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时
,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时 体积分数为
体积分数为
 (
( 为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。(5)研究
 在水溶液中的电离平衡有重要意义。若室温下将
在水溶液中的电离平衡有重要意义。若室温下将 的
的 溶液和
溶液和 溶液等体积混合,恢复至室温后混合溶液中存在
溶液等体积混合,恢复至室温后混合溶液中存在 。则乙酸的电离平衡常数
。则乙酸的电离平衡常数
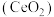 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 能与
能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)“氧化焙烧”中氧化的目的是
(2)“酸浸”时提高浸取率的方法
(3)“萃取”时存在反应:
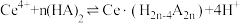 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
(4)“反萃取”中,在稀硫酸和
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(5)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)(6)二氧化铈(
 )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物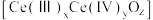 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为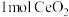 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为
已知:
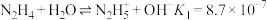 ;
; 。
。有关反应的方程式错误的是
A.羟胺还原 的反应: 的反应: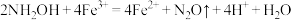 |
B.羟胺分解的反应: |
C.向羟胺溶液中滴加过量稀硫酸: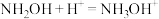 |
D.向(NH4)2SO4溶液中加入NH2OH: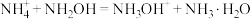 |
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
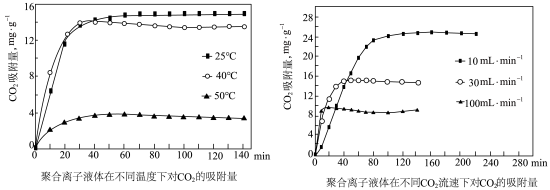
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。
(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
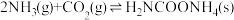
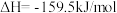
第二步:

写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示: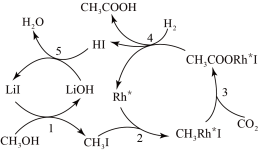
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
(1)NH3极易溶于水且溶液显碱性,请用化学方程式解释原因:
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=
③0.1mol/LNa2N2O2溶液中离子浓度由大到小的顺序为
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ:2NH3(g)+CO2(g)
 NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;反应Ⅲ:H2O(l)=H2O(g) ΔH3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g

①T1℃时,NH3的平衡转化率=
②图2中能正确反应平衡常数K随温度变化关系的曲线为
7 . 温室气体的利用是当前环境和能源领域的研究热点。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)→NH2COONH4(s) ΔH1=-159.5 kJ/mol
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.5 kJ/mol
总反应Ⅲ:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=______kJ/mol
①反应Ⅲ的ΔH3=
②一定温度下,在体积固定的密闭容器中将NH3和CO2按2:1投入进行反应合成尿素,下列能说明反应I达到化学平衡状态的是
a.体系内固体质量不改变
b.NH3的物质的量分数不再变化
c.2v正(NH3)=v逆(CO2)
d.容器内混合气体的密度不再变化
(2)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、H2),发生反应为:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH>0,将等物质的量的甲烷和水蒸气投入一个刚性容器中,图中a、b两条曲线代表压强分别为1MPa、2MPa时甲烷平衡含量曲线,其中表示1MPa的是

(3)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如下图所示。过程②的化学方程式是

(4)已知:
表1 25℃时浓度为0.1mol/L两种溶液的pH
溶质 | NaClO | Na2CO3 |
pH | 9.7 | 11.6 |
表2 25℃时两种酸的电离平衡常数
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①根据表1能不能判断出H2CO3与HClO酸性强弱?
②H2SO3溶液和NaHCO3溶液反应的离子方程式为
(1)煤的直接甲烷化反应为

 ,在不同含金催化剂条件下的反应历程如下图所示:
,在不同含金催化剂条件下的反应历程如下图所示:

催化煤的直接甲烷化效果较好的催化剂是
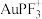 ”),该反应在
”),该反应在(2)煤的液化可以合成甲醇。已知
“气化”:


催化液化Ⅰ:
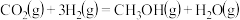

催化液化Ⅱ:


则反应

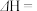
 。
。(3)一定温度时,以水煤气为原料合成甲醇的反应
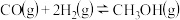 的平衡常数为
的平衡常数为 ,向恒容容器中充入2mol H2和1mol CO,反应达平衡状态时,甲醇的分压
,向恒容容器中充入2mol H2和1mol CO,反应达平衡状态时,甲醇的分压 ,则平衡时,混合气体中CH3OH的物质的量分数为
,则平衡时,混合气体中CH3OH的物质的量分数为(4)燃煤烟气脱硫的方法有多种。其中有种方法是用氨水将SO2转化为NH4HSO3,再氧化成
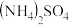 。已知常温下亚硫酸的电离常数
。已知常温下亚硫酸的电离常数 ,
, ,一水合氨的电离常数为
,一水合氨的电离常数为 。
。①向混合液中通空气氧化的离子反应方程式:
②关于NH4HSO3溶液,下列说法正确的是:
A.NH4HSO3溶液呈酸性是因为

B.NH4HSO3溶液中

C.NH4HSO3溶液中

D.NH4HSO3溶液中

③常温下,若溶液中
 时,溶液的pH=
时,溶液的pH=(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:| 共价键 | C—O | H—O | N—H | C—N | C—H |
| 键能/kJ·mol−1 | 351 | 463 | 393 | 293 | 414 |
(2)上述反应中所需的甲醇工业上利用水煤气合成CO(g)+2H2(g)
 CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
(3)工业上可采用CH3OH
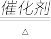 CO+2H2来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯基催化剂表面上的物种用*标注。
CO+2H2来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯基催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式A:CH3OH* →CH3O* +H* Ea= +103.1 kJ·mol−1
方式B:CH3OH* →CH3* +OH* Eb= +249.3 kJ·mol−1
实验证实甲醇裂解过程主要历经的方式为A,试推测可能的原因
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为
(4)PbI2与金属锂以LiI−Al2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为:2Li+PbI2===2LiI+Pb,则b极上的电极反应式为

(5)CH3NH2的电离方程式为CH3NH2+H2O

 +OH−,电离常数为Kb,已知常温下pKb=−lgKb=3.4,则常温下向CH3NH2溶液中滴加稀硫酸至c(CH3NH2)=c(
+OH−,电离常数为Kb,已知常温下pKb=−lgKb=3.4,则常温下向CH3NH2溶液中滴加稀硫酸至c(CH3NH2)=c( )时,溶液pH=
)时,溶液pH=(1)水能发生自偶电离2H2O
 H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=
③0.lmol/L NaHN2O2溶液中离子浓度由大到小的顺序为
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)
 NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
NH2CO2NH4(s) △H1=-159.5kJ•mol-1;反应II:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;反应III:H2O(l)═H2O(g) △H3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为
②图2中能正确反应平衡常数K随温度变化关系的曲线为
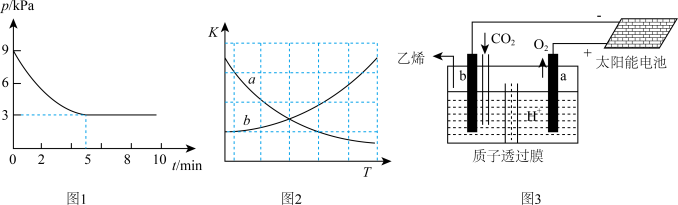
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为



