解题方法
1 . 电解质的水溶液中存在电离平衡。
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为_______ 。
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)________ 。
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。_______ 。
②滴定醋酸的曲线是_______ (填“I”或“Ⅱ”),则V1______ V2(填“>”、 “<”“或“=”)。
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为_____ mL。 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①该滴定过程应选择______ (填“甲基橙”或“酚酞”)为指示剂,根据上述数据,可计算出该醋酸的浓度约为_____  。
。
②在上述实验中,下列操作会造成测定结果偏大的有______ 。(填字母序号)。
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为
 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。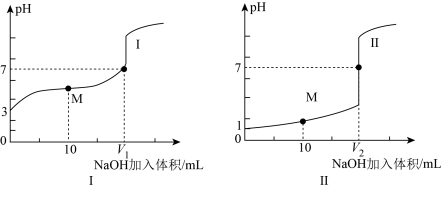
②滴定醋酸的曲线是
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为

 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测醋酸的体积(mL) |
| 1 | 0.1000 | 22.48 | 20.00 |
| 2 | 0.1000 | 25.72 | 20.00 |
| 3 | 0.1000 | 22.52 | 20.00 |
 。
。②在上述实验中,下列操作会造成测定结果偏大的有
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
2 . 完成下列问题。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
①亚硫酸发生电离的方程式为______ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:______ 。
③在相同条件下,试比较H2CO3、 和
和 的酸性强弱:
的酸性强弱:____ >____ >____ 。
(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:____ 。
②a、b、c三点溶液的pH由大到小的顺序为____ ,电离程度最大的是____ 。
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择____ (填字母)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较H2CO3、
 和
和 的酸性强弱:
的酸性强弱:(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:
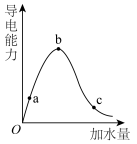
②a、b、c三点溶液的pH由大到小的顺序为
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
A.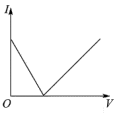 | B.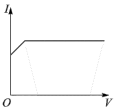 | C.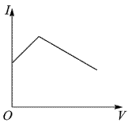 | D.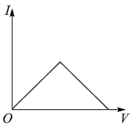 |
您最近一年使用:0次
名校
解题方法
3 . I.根据表中数据(常温下),完成下列填空。
(1)常温下,NaCN溶液呈___________ (填“酸”、“碱”或“中”)性,其原因是___________ (用离子方程式表示)。
(2)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为___________ 。
(3)常温下,Na2SO3溶液中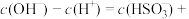
___________ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。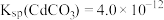 ,
,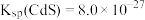 ;回答下列问题:
;回答下列问题:
(4)向某含镉废水中加入Na2S,当 浓度达到
浓度达到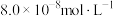 时,废水中Cd2+的浓度为
时,废水中Cd2+的浓度为___________  ,此时是否符合生活饮用水卫生标准?
,此时是否符合生活饮用水卫生标准?____________ (填“是”或“否”)
(5)室温下,反应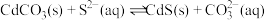 达到平衡,该反应的平衡常数K=
达到平衡,该反应的平衡常数K=___________ (结果保留两位有效数字)
| 物质 | CH3COOH | NH3•H2O | HCN | HClO | H2CO3 | H2SO3 |
| 电离常数(Ka) |  |  |  |  | 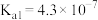 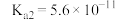 | 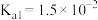  |
(2)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为
(3)常温下,Na2SO3溶液中
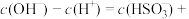
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005
 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。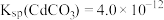 ,
,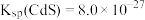 ;回答下列问题:
;回答下列问题:(4)向某含镉废水中加入Na2S,当
 浓度达到
浓度达到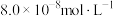 时,废水中Cd2+的浓度为
时,废水中Cd2+的浓度为 ,此时是否符合生活饮用水卫生标准?
,此时是否符合生活饮用水卫生标准?(5)室温下,反应
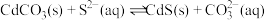 达到平衡,该反应的平衡常数K=
达到平衡,该反应的平衡常数K=
您最近一年使用:0次
4 . 已知:连二次硝酸( )是二元酸,可用于制取
)是二元酸,可用于制取 气体。在常温下,用
气体。在常温下,用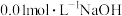 溶液滴定
溶液滴定 溶液,测得溶液的
溶液,测得溶液的 与
与 溶液体积的关系如图所示。
溶液体积的关系如图所示。

回答下列问题。
(1)滴定过程中盛装标准 溶液应选用
溶液应选用________ (填字母)仪器。

(2)常温下, 的
的
________ 。
(3)已知常温下 ,
, 与
与 溶液
溶液________ (填“能”或“不能”)反应。
(4)滴定过程中,由水电离出的 大小关系:
大小关系:
________ (填“>”“<”或“=”) 。
。
(5) 点溶液中
点溶液中
________ (填“>”“<”或“=”) 。
。
(6) 点溶液中含氮粒子浓度由大到小的顺序是
点溶液中含氮粒子浓度由大到小的顺序是________ 。
(7) 点溶液和
点溶液和 溶液混合,可得黄色的
溶液混合,可得黄色的 沉淀,再向该体系中滴加
沉淀,再向该体系中滴加 溶液,此时白色和黄色沉淀共存,该体系中
溶液,此时白色和黄色沉淀共存,该体系中
________ 。[已知 ,
, ]
]
 )是二元酸,可用于制取
)是二元酸,可用于制取 气体。在常温下,用
气体。在常温下,用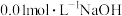 溶液滴定
溶液滴定 溶液,测得溶液的
溶液,测得溶液的 与
与 溶液体积的关系如图所示。
溶液体积的关系如图所示。
回答下列问题。
(1)滴定过程中盛装标准
 溶液应选用
溶液应选用
(2)常温下,
 的
的
(3)已知常温下
 ,
, 与
与 溶液
溶液(4)滴定过程中,由水电离出的
 大小关系:
大小关系:
 。
。(5)
 点溶液中
点溶液中
 。
。(6)
 点溶液中含氮粒子浓度由大到小的顺序是
点溶液中含氮粒子浓度由大到小的顺序是(7)
 点溶液和
点溶液和 溶液混合,可得黄色的
溶液混合,可得黄色的 沉淀,再向该体系中滴加
沉淀,再向该体系中滴加 溶液,此时白色和黄色沉淀共存,该体系中
溶液,此时白色和黄色沉淀共存,该体系中
 ,
, ]
]
您最近一年使用:0次
名校
5 . 平衡思想是化学研究一个重要观念。电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①常温下,0.1mol·L−1的 溶液中c(H+)=
溶液中c(H+)=_______ 。
②常温下,物质的量浓度均为0.1mol·L−1的下列四种溶液显_______ 性:pH由小到大排列的顺序是_______ (按序号排列)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)含镉(Cd2+)废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。已知,常温下,Ksp[Cd(OH)2]=3.2×10-14、Ksp[CdCO3]=5.6×10-12、Ksp[CaCO3]=2.8×10-9、Ksp[CdS]=10-26.1。
①沉淀Cd2+效果最佳的试剂是_______ (填标号)。
a.CaO b.Na2CO3 c.Na2S
②Cd(OH)2]的溶度积常数表达式Ksp[Cd(OH)2]=_______ ,若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_______ 。
③若加入CaCO3替代Na2CO3实现沉淀转化。碳酸钙处理Cd2+的离子方程式是_______ 。
(1)已知部分弱酸的电离常数如下表:
| 化学式 | HF |  |  | HClO |
| 电离平衡常数 | 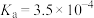 |  |   | 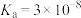 |
 溶液中c(H+)=
溶液中c(H+)=②常温下,物质的量浓度均为0.1mol·L−1的下列四种溶液显
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)含镉(Cd2+)废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。已知,常温下,Ksp[Cd(OH)2]=3.2×10-14、Ksp[CdCO3]=5.6×10-12、Ksp[CaCO3]=2.8×10-9、Ksp[CdS]=10-26.1。
①沉淀Cd2+效果最佳的试剂是
a.CaO b.Na2CO3 c.Na2S
②Cd(OH)2]的溶度积常数表达式Ksp[Cd(OH)2]=
③若加入CaCO3替代Na2CO3实现沉淀转化。碳酸钙处理Cd2+的离子方程式是
您最近一年使用:0次
6 . 现有HA、HB、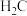 三种酸,室温下用
三种酸,室温下用 的
的 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的HA、HB两种酸的溶液,滴定过程中溶液的
的HA、HB两种酸的溶液,滴定过程中溶液的 随滴入的
随滴入的 溶液体积的变化如图所示:
溶液体积的变化如图所示:

(1)曲线I上的c点对应的溶液中各离子浓度的大小顺序为__________ ,b点对应的溶液中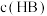
____ 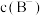 (填“>”“<”或“=”).
(填“>”“<”或“=”).
(2)a点时的溶液中由水电离出的
_______  ,
,
__________ .
(3)已知向 的
的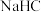 溶液中滴入几滴石蕊溶液后变成红色.若在此溶液中能检测到
溶液中滴入几滴石蕊溶液后变成红色.若在此溶液中能检测到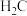 分子,则此溶液中
分子,则此溶液中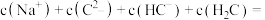
________ (填具体数据).
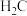 三种酸,室温下用
三种酸,室温下用 的
的 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的HA、HB两种酸的溶液,滴定过程中溶液的
的HA、HB两种酸的溶液,滴定过程中溶液的 随滴入的
随滴入的 溶液体积的变化如图所示:
溶液体积的变化如图所示:
(1)曲线I上的c点对应的溶液中各离子浓度的大小顺序为
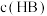
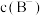 (填“>”“<”或“=”).
(填“>”“<”或“=”).(2)a点时的溶液中由水电离出的

 ,
,
(3)已知向
 的
的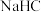 溶液中滴入几滴石蕊溶液后变成红色.若在此溶液中能检测到
溶液中滴入几滴石蕊溶液后变成红色.若在此溶液中能检测到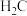 分子,则此溶液中
分子,则此溶液中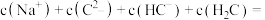
您最近一年使用:0次
7 . 回答下列问题
(1)实验室在配制 的溶液时,为了抑制
的溶液时,为了抑制 的水解可加入少量的
的水解可加入少量的_______ (填写物质的名称).把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是________ (填化学式).
(2)已知 水溶液呈碱性,其原因是
水溶液呈碱性,其原因是_________ (用离子方程式和相应的文字解释).
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.
高铁电池的总反应为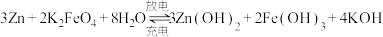 .充电时,阳极反应式为
.充电时,阳极反应式为______________ .
(1)实验室在配制
 的溶液时,为了抑制
的溶液时,为了抑制 的水解可加入少量的
的水解可加入少量的 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(2)已知
 水溶液呈碱性,其原因是
水溶液呈碱性,其原因是(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.
高铁电池的总反应为
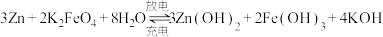 .充电时,阳极反应式为
.充电时,阳极反应式为
您最近一年使用:0次
8 . 硼及其化合物在制造、化工等领域都有广泛应用,回答下列问题:
(1)基态硼原子的价电子排布图为__________ ,其占据最高能级电子的电子云轮廓图形状为__________ ,基态硼原子比基态氮原子的第一电离能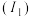 小,其原因为
小,其原因为__________ 。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:
① 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为__________ 。
② 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为__________ 。
③ 的键角为
的键角为__________ 。
(3)写出B与 溶液反应的离子方程式:
溶液反应的离子方程式:__________ 。
(4) 为一元弱酸[常温下,
为一元弱酸[常温下,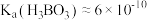 ]:
]:
① 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为__________ 。
②常温下, 的硼酸的pH约为
的硼酸的pH约为__________ (已知: ,
, )。
)。
(1)基态硼原子的价电子排布图为
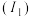 小,其原因为
小,其原因为(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:①
 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为②
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为③
 的键角为
的键角为(3)写出B与
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)
 为一元弱酸[常温下,
为一元弱酸[常温下,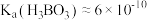 ]:
]:①
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为②常温下,
 的硼酸的pH约为
的硼酸的pH约为 ,
, )。
)。
您最近一年使用:0次
2024-03-07更新
|
128次组卷
|
2卷引用:河南省许平汝名校2023-2024学年高二下学期开学化学试题
名校
9 . 已知:25℃时,相关酸的电离平衡常数如下表所示,请回答下列问题:
(1) 的电离平衡常数表达式
的电离平衡常数表达式
___________ 。常温下,下列事实能说明 是弱电解质的是
是弱电解质的是___________ (填写序号)
① 与水能以任意比互溶
与水能以任意比互溶
②0.1 mol/L 溶液导电能力比0.1 mol/L盐酸弱
溶液导电能力比0.1 mol/L盐酸弱
③常温下 的
的 溶液稀释十倍后
溶液稀释十倍后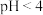
④ 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大
⑥大小相同的锌片与同体积同浓度的盐酸和 反应,产生
反应,产生 的物质的量相同
的物质的量相同
(2)25℃时,0.1 mol/L的① ②
② ③NaCN三种溶液的pH由大到小的顺序是:
③NaCN三种溶液的pH由大到小的顺序是:___________ (填写序号)。
(3)0.1 mol/L 溶液加水稀释后,
溶液加水稀释后,
___________ (填“增大”、“减小”或“不变”),
___________ (填“增大”、“减小”或“不变”)。
(4)常温下用0.10 mol/L的NaOH溶液滴定20.00 mL 0.10 mol/L的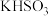 溶液,溶液pH的变化曲线如图所示(忽略空气的影响)。下列叙述中正确的是
溶液,溶液pH的变化曲线如图所示(忽略空气的影响)。下列叙述中正确的是___________ (填写序号)

①a点溶液中:
②b点溶液中:
③c点溶液中:
④d点水的电离程度大于c点
(5)向 溶液中通入
溶液中通入 ,
, 与
与 发生的主要离子反应为
发生的主要离子反应为___________ ,
___________ 。
| 酸 |  | HClO | HCN |  |  |
| 电离常数(K) |  |  | 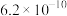 |   | 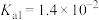 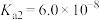 |
(1)
 的电离平衡常数表达式
的电离平衡常数表达式
 是弱电解质的是
是弱电解质的是①
 与水能以任意比互溶
与水能以任意比互溶②0.1 mol/L
 溶液导电能力比0.1 mol/L盐酸弱
溶液导电能力比0.1 mol/L盐酸弱③常温下
 的
的 溶液稀释十倍后
溶液稀释十倍后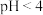
④
 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向
 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大⑥大小相同的锌片与同体积同浓度的盐酸和
 反应,产生
反应,产生 的物质的量相同
的物质的量相同(2)25℃时,0.1 mol/L的①
 ②
② ③NaCN三种溶液的pH由大到小的顺序是:
③NaCN三种溶液的pH由大到小的顺序是:(3)0.1 mol/L
 溶液加水稀释后,
溶液加水稀释后,

(4)常温下用0.10 mol/L的NaOH溶液滴定20.00 mL 0.10 mol/L的
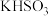 溶液,溶液pH的变化曲线如图所示(忽略空气的影响)。下列叙述中正确的是
溶液,溶液pH的变化曲线如图所示(忽略空气的影响)。下列叙述中正确的是
①a点溶液中:

②b点溶液中:

③c点溶液中:

④d点水的电离程度大于c点
(5)向
 溶液中通入
溶液中通入 ,
, 与
与 发生的主要离子反应为
发生的主要离子反应为
您最近一年使用:0次
10 . 研究化学反应意义重大,请就下列现象和实质回答问题。
(1) 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 (
( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等),写出
等),写出 水解生成
水解生成 的水解反应方程式
的水解反应方程式______ 。
(2)次磷酸( )是一种弱酸,
)是一种弱酸, 溶液和足量
溶液和足量 溶液混合,所得溶液中阴离子只有
溶液混合,所得溶液中阴离子只有 、
、 两种。写出
两种。写出 溶液与
溶液与 溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为
溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为_______ 。
(3)已知 与
与 溶液反应生成
溶液反应生成 ,与稀硫酸反应生成
,与稀硫酸反应生成 ,写出
,写出 在水中的两种电离方程式
在水中的两种电离方程式_______ 、_______ 。
(4)一定温度下,用水吸收 气体时,溶液中水的电离平衡
气体时,溶液中水的电离平衡_______ 移动(填“向左”“向右”或“不”);若得到 的
的 溶液,试计算溶液中
溶液,试计算溶液中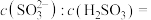
_______ (已知该温度下, 的电离常数:
的电离常数: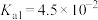 ,
, )。
)。
(5)某温度下, 的盐酸中
的盐酸中 ;该温度下
;该温度下 的
的 溶液与
溶液与 的
的 溶液混合后溶液的
溶液混合后溶液的 ,则
,则 与
与 溶液的体积比为
溶液的体积比为_______ 。
(6) 时,若向
时,若向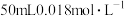 的
的 溶液中加入
溶液中加入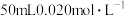 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的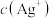 为
为______  (
( 时,
时, )。
)。
(1)
 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 (
( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等),写出
等),写出 水解生成
水解生成 的水解反应方程式
的水解反应方程式(2)次磷酸(
 )是一种弱酸,
)是一种弱酸, 溶液和足量
溶液和足量 溶液混合,所得溶液中阴离子只有
溶液混合,所得溶液中阴离子只有 、
、 两种。写出
两种。写出 溶液与
溶液与 溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为
溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为(3)已知
 与
与 溶液反应生成
溶液反应生成 ,与稀硫酸反应生成
,与稀硫酸反应生成 ,写出
,写出 在水中的两种电离方程式
在水中的两种电离方程式(4)一定温度下,用水吸收
 气体时,溶液中水的电离平衡
气体时,溶液中水的电离平衡 的
的 溶液,试计算溶液中
溶液,试计算溶液中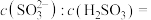
 的电离常数:
的电离常数: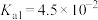 ,
, )。
)。(5)某温度下,
 的盐酸中
的盐酸中 ;该温度下
;该温度下 的
的 溶液与
溶液与 的
的 溶液混合后溶液的
溶液混合后溶液的 ,则
,则 与
与 溶液的体积比为
溶液的体积比为(6)
 时,若向
时,若向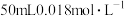 的
的 溶液中加入
溶液中加入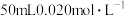 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的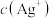 为
为 (
( 时,
时, )。
)。
您最近一年使用:0次



