解题方法
1 . 草酸 是一种白色粉末,
是一种白色粉末,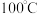 左右开始少量升华,熔点为
左右开始少量升华,熔点为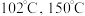 左右分解产生
左右分解产生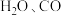 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为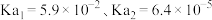 。
。
1.草酸可用于实验室制备少量 气体,应选择的发生装置为
气体,应选择的发生装置为___________ 。
常温下,向某浓度的草酸溶液中加入一定量等浓度的 溶液。
溶液。
3.当 时,溶液呈___________。
时,溶液呈___________。
A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中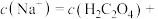
___________ 。
4.当 时,计算该溶液的
时,计算该溶液的
___________ 。(结果保留两位小数)计算过程。
 是一种白色粉末,
是一种白色粉末,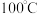 左右开始少量升华,熔点为
左右开始少量升华,熔点为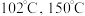 左右分解产生
左右分解产生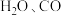 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为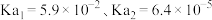 。
。1.草酸可用于实验室制备少量
 气体,应选择的发生装置为
气体,应选择的发生装置为
A.用足量的 溶液充分吸收后,可收集得到纯净的 溶液充分吸收后,可收集得到纯净的 |
| B.通过灼热的氧化铜,若出现黑色变红色现象,则产生的气体中一定有CO |
C.通入足量的澄清石灰水中,若能产生白色沉淀,则产生的气体中一定有 |
D.通入酸性 溶液中,若能使溶液褪色,说明草酸具有还原性 溶液中,若能使溶液褪色,说明草酸具有还原性 |
常温下,向某浓度的草酸溶液中加入一定量等浓度的
 溶液。
溶液。3.当
 时,溶液呈___________。
时,溶液呈___________。A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中
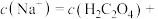
4.当
 时,计算该溶液的
时,计算该溶液的
您最近一年使用:0次
2 . 下图是石灰石膏法脱硫的示意图。烟气在脱硫塔内与脱硫剂(石灰石/生石灰浆液)接触混合,继而与鼓入的空气中的氧气发生化学反应,生成石膏(CaSO4·2H2O)。脱硫后的烟气经过除雾器除去雾滴后,排至大气。
1.烟气进口:_____ 。(填a或b)
2.为避免操作不当引起的中间产物CaSO3结垢和堵塞现象,某公司在脱硫剂中加入少量甲酸,效果很好。写出少量甲酸和CaSO3反应的化学方程式:_____ 。
| HCOOH | Ka=1.80×10-4 | |
| H2SO3 | Ka1=1.2×10-2 | Ka2=6.2×10-8 |
| H2CO3 | Ka1=4.2×10-7 | Ka2=4.8×10-11 |
1.烟气进口:
2.为避免操作不当引起的中间产物CaSO3结垢和堵塞现象,某公司在脱硫剂中加入少量甲酸,效果很好。写出少量甲酸和CaSO3反应的化学方程式:
您最近一年使用:0次
3 . 生物质铁炭纳米材料可以活化过一硫酸盐,降解废水中有机污染物.
(1)生物质铁炭纳米材料活化过—硫酸钾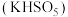 降解有机污染物的反应历程如图-1所示.图中
降解有机污染物的反应历程如图-1所示.图中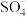 和
和 分别表示硫酸根自由基和羟基自由基.
分别表示硫酸根自由基和羟基自由基. (S的化合价为
(S的化合价为 )在水中的电离过程为:
)在水中的电离过程为: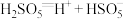 、
、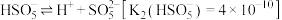 .写出
.写出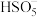 的结构式:
的结构式:_______ 。
②生物质铁炭纳米材料降解有机污染物的机理可描述为______ 。
③若有机污染物为苯酚,写出酸性条件下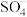 与苯酚反应的化学方程式:
与苯酚反应的化学方程式:______ 。
(2)与直接使用纳米铁颗粒相比,使用生物质铁炭纳米材料降解的优点是:______ 。
(3)铁炭纳米材料在不同 对有机污染物去除率(
对有机污染物去除率( 溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示,
溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示, 越小有机污染物去除率越高的原因是:
越小有机污染物去除率越高的原因是:______ 。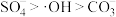 。水中存在一定量
。水中存在一定量 和无
和无 存在时对铁炭纳米材料降解有机污染物的影响如图-3所示.
存在时对铁炭纳米材料降解有机污染物的影响如图-3所示. 的存在对有机污染物的降解有影响,原因是:
的存在对有机污染物的降解有影响,原因是:______ 。
(1)生物质铁炭纳米材料活化过—硫酸钾
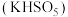 降解有机污染物的反应历程如图-1所示.图中
降解有机污染物的反应历程如图-1所示.图中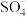 和
和 分别表示硫酸根自由基和羟基自由基.
分别表示硫酸根自由基和羟基自由基.
 (S的化合价为
(S的化合价为 )在水中的电离过程为:
)在水中的电离过程为: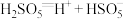 、
、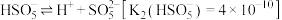 .写出
.写出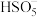 的结构式:
的结构式:②生物质铁炭纳米材料降解有机污染物的机理可描述为
③若有机污染物为苯酚,写出酸性条件下
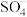 与苯酚反应的化学方程式:
与苯酚反应的化学方程式:(2)与直接使用纳米铁颗粒相比,使用生物质铁炭纳米材料降解的优点是:
(3)铁炭纳米材料在不同
 对有机污染物去除率(
对有机污染物去除率( 溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示,
溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示, 越小有机污染物去除率越高的原因是:
越小有机污染物去除率越高的原因是: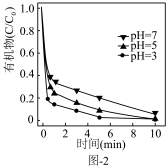
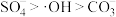 。水中存在一定量
。水中存在一定量 和无
和无 存在时对铁炭纳米材料降解有机污染物的影响如图-3所示.
存在时对铁炭纳米材料降解有机污染物的影响如图-3所示. 的存在对有机污染物的降解有影响,原因是:
的存在对有机污染物的降解有影响,原因是: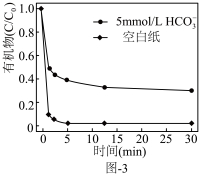
您最近一年使用:0次
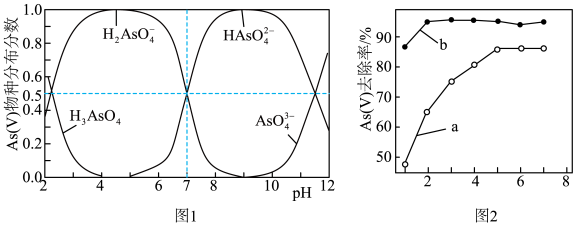
4 . 研究水质除砷技术对保护环境有重要意义。
已知:As(V)在不同pH条件下的物种分布分数如图1所示。
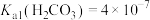 ,
,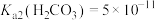 ;
;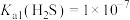 ,
,
(1)硫化法:As(Ⅲ)能与硫化剂(能提供 )反应生成雌黄(
)反应生成雌黄( )沉淀。HCHO能在硫酸盐还原菌的作用下将
)沉淀。HCHO能在硫酸盐还原菌的作用下将 还原为
还原为 ,同时生成
,同时生成 。
。
①沉淀1 mol As(Ⅲ)理论上需消耗HCHO的物质的量为______ mol。
② 能与
能与 反应:
反应: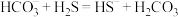 。该反应的平衡常数
。该反应的平衡常数
______ 。
(2)石灰沉淀法:向含砷(V)废水中添加石灰水,可使砷元素转化为多种砷酸钙盐沉淀。
①向中性废水中加入适量石灰水,使As(V)完全转化为 沉淀。写出该反应的离子方程式:
沉淀。写出该反应的离子方程式:____________ 。
②向含 沉淀的悬浊液中通入
沉淀的悬浊液中通入 气体,可得到
气体,可得到 。该转化能实现的原因是
。该转化能实现的原因是____________ 。
③控制其他条件不变,向碱性含砷(V)废水中加入一定量石灰水,测得As(V)去除率在30℃以后随温度升高而降低。可能的原因是__________________ 。
④在初始pH、c[As(V)]相同的模拟废水中加入石灰水,As(V)去除率随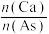 的变化如图2曲线a所示;固定
的变化如图2曲线a所示;固定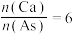 ,往石灰水中添加Fe(Ⅲ)盐,As(V)去除率随
,往石灰水中添加Fe(Ⅲ)盐,As(V)去除率随 的变化如图2曲线b所示。加入Fe(Ⅲ)盐后,As(V)去除率增大的原因是
的变化如图2曲线b所示。加入Fe(Ⅲ)盐后,As(V)去除率增大的原因是____________ 。
已知:As(V)在不同pH条件下的物种分布分数如图1所示。
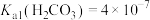 ,
,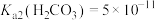 ;
;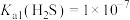 ,
,

(1)硫化法:As(Ⅲ)能与硫化剂(能提供
 )反应生成雌黄(
)反应生成雌黄( )沉淀。HCHO能在硫酸盐还原菌的作用下将
)沉淀。HCHO能在硫酸盐还原菌的作用下将 还原为
还原为 ,同时生成
,同时生成 。
。①沉淀1 mol As(Ⅲ)理论上需消耗HCHO的物质的量为
②
 能与
能与 反应:
反应: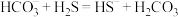 。该反应的平衡常数
。该反应的平衡常数
(2)石灰沉淀法:向含砷(V)废水中添加石灰水,可使砷元素转化为多种砷酸钙盐沉淀。
①向中性废水中加入适量石灰水,使As(V)完全转化为
 沉淀。写出该反应的离子方程式:
沉淀。写出该反应的离子方程式:②向含
 沉淀的悬浊液中通入
沉淀的悬浊液中通入 气体,可得到
气体,可得到 。该转化能实现的原因是
。该转化能实现的原因是③控制其他条件不变,向碱性含砷(V)废水中加入一定量石灰水,测得As(V)去除率在30℃以后随温度升高而降低。可能的原因是
④在初始pH、c[As(V)]相同的模拟废水中加入石灰水,As(V)去除率随
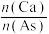 的变化如图2曲线a所示;固定
的变化如图2曲线a所示;固定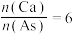 ,往石灰水中添加Fe(Ⅲ)盐,As(V)去除率随
,往石灰水中添加Fe(Ⅲ)盐,As(V)去除率随 的变化如图2曲线b所示。加入Fe(Ⅲ)盐后,As(V)去除率增大的原因是
的变化如图2曲线b所示。加入Fe(Ⅲ)盐后,As(V)去除率增大的原因是
您最近一年使用:0次
名校
5 . 工业排放的某些烟气中含有二氧化硫等大气污染物,对其进行脱硫治理不仅可以防止有害物质排放,还可以生产其他有用的产品。
(1) 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。
(2)第一电离能: ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因___________ 。
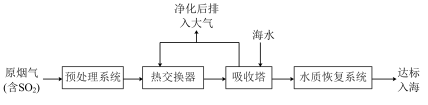
沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示: ,
, 的电离常数如下表所示:
的电离常数如下表所示:
(3)在吸收塔内,烟气应从吸收塔的___________ 通入,与塔顶喷淋的海水充分接触。
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是___________ 。(列举1条)吸收塔内 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)若煤电厂排放烟气量为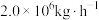 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
___________ 。( )
)
(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收 后生成
后生成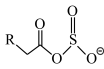 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。
工业上还可用 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
(7)为使 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
(8)使用 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在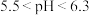 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因___________ 。
(1)
 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。| A.直线形,非极性 | B.直线形,极性 | C.角形,非极性 | D.角形,极性 |
(2)第一电离能:
 ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示:
 ,
, 的电离常数如下表所示:
的电离常数如下表所示:| 弱酸 |  |  |
 | 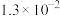 | 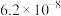 |
 | 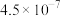 | 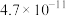 |
(3)在吸收塔内,烟气应从吸收塔的
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是
 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为(5)若煤电厂排放烟气量为
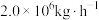 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
 )
)(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收
 后生成
后生成 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。| A.原子发射光谱 | B.红外光谱 | C.核磁共振氢谱 | D.晶体X射线衍射 |
工业上还可用
 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。(7)为使
 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。A. | B.CaO | C. | D.NaOH |
(8)使用
 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在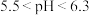 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因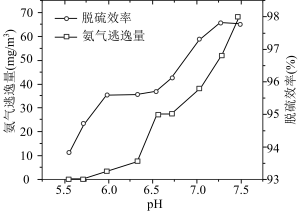
您最近一年使用:0次
2024-01-13更新
|
293次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
名校
6 . 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
(1)HF、H2CO3、HClO酸性由强到弱的顺序为_______ 。物质的量浓度均为0.1mol/L的下列溶液:a.Na2CO3 b.NaClO c.NaHCO3 d.NaF,pH值由大到小的顺序是_______ (填编号)
(2)将浓度为0.1mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是_______。
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。
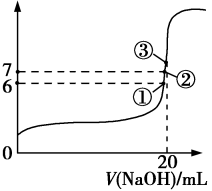
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(2)将浓度为0.1mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是_______。
| A.c(H+) | B.c(H+)·c(OH-) | C.c(H+)/c(HF) | D.c(OH-)/c(H+) |

| A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 |
| B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L |
| C.②点时,溶液中的c(F-)=c(Na+) |
| D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol/L |
您最近一年使用:0次
2022-04-15更新
|
193次组卷
|
3卷引用:2024届山东省潍坊实验中学高三上学期模拟预测化学试题
名校
7 . 砷(As)与N、P是同主族元素,远古时期人们就开始开发利用砷的性质,现代技术中砷仍然起着非常重要的作用。请回答下列问题:
(1)砷只有一种稳定的同位素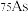 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多_______ (填数值)。
(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
(3)Marsh试砷法和Gutzeit试砷法是法医学上鉴定砷的重要方法。其原理是先将 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。
① 的电子式为
的电子式为_______ 。
②Gutzeit试砷法中 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为_______ ;砷化镓也可用于制造太阳能电池,该电池工作时的能量转化形式为_______ 。
(5)已知 的电离平衡常数分别为
的电离平衡常数分别为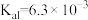 、
、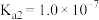 、
、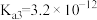 。
。
①25℃时,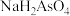 ,溶液中:
,溶液中: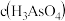
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②25℃时,向 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中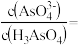
_______ 。
(1)砷只有一种稳定的同位素
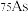 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
A.沸点: |
B.等物质的量浓度溶液的酸性: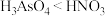 |
C.分解温度: |
D.相对分子质量: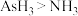 |
 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。①
 的电子式为
的电子式为②Gutzeit试砷法中
 被氧化的离子方程式为
被氧化的离子方程式为(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用
 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为(5)已知
 的电离平衡常数分别为
的电离平衡常数分别为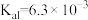 、
、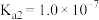 、
、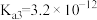 。
。①25℃时,
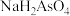 ,溶液中:
,溶液中: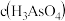
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②25℃时,向
 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中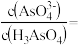
您最近一年使用:0次
2021-12-06更新
|
630次组卷
|
3卷引用:河南省部分重点高中2021-2022学年高三上学期12月适应性检测化学试题
8 . 人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风,NaUr(s)  Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,Ka(HUr) = 4×10−6,Kw = 2.4×10−14,Ksp(NaUr) = 6.4×10−5
②37℃时,模拟关节滑液pH =7.4,c(Ur-) =4.6×10−4 mol∙L−1
(1)尿酸电离方程式为_______
(2)Kh为盐的水解常数,37℃时,Kh(Ur−)=_______ 。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)_______ c(Ur−) (填“>”、“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol∙L−1时,通过计算判断是否有NaUr晶体析出,请写出判断过程_______
(5)对于尿酸偏高的人群,下列建议正确的是_______ 。
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
 Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:①37℃时,Ka(HUr) = 4×10−6,Kw = 2.4×10−14,Ksp(NaUr) = 6.4×10−5
②37℃时,模拟关节滑液pH =7.4,c(Ur-) =4.6×10−4 mol∙L−1
(1)尿酸电离方程式为
(2)Kh为盐的水解常数,37℃时,Kh(Ur−)=
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol∙L−1时,通过计算判断是否有NaUr晶体析出,请写出判断过程
(5)对于尿酸偏高的人群,下列建议正确的是
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
您最近一年使用:0次
2021-05-27更新
|
709次组卷
|
7卷引用:海南省海口市2020届高三6月等级模拟试卷化学试题
海南省海口市2020届高三6月等级模拟试卷化学试题福建省福州一中2021届高三第五次模拟考试化学试题(已下线)第03章 物质在水溶液中的行为(A卷基础强化卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)海南省北京师范大学万宁附属中学2021届高三上学期第一次月考化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测(已下线)第25讲 盐类水解(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第4讲 盐类的水解
解题方法
9 . (1)已知氯乙酸的酸性强于醋酸,则酸性:
___________  (填:>、<或=)。
(填:>、<或=)。
(2)次磷酸( )与足量
)与足量 溶液反应生成
溶液反应生成 ,据此写出
,据此写出 的结构式
的结构式___________ 。
注:磷酸的结构式为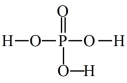
(3)常压下,苯和甲苯的熔、沸点如下表:
①苯的沸点比甲苯的沸点更低,主要原因是___________ 。
②苯晶体的熔点比甲苯的熔点更高,主要原因是___________ 。

 (填:>、<或=)。
(填:>、<或=)。(2)次磷酸(
 )与足量
)与足量 溶液反应生成
溶液反应生成 ,据此写出
,据此写出 的结构式
的结构式注:磷酸的结构式为

(3)常压下,苯和甲苯的熔、沸点如下表:
| 苯的模型 |  | 熔点: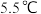 | 甲苯模型 |  | 熔点: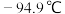 |
沸点: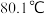 | 沸点: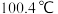 |
②苯晶体的熔点比甲苯的熔点更高,主要原因是
您最近一年使用:0次
解题方法
10 . 碳酸和一水合氨是重要的弱酸和弱碱,常温下,其电离常数如下表所示。回答下列问题:
(1)碳酸的一级电离方程式为______ ,二级电离常数表达式
________ 。
(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是_______ (写化学式),混合溶液中 、
、 、
、 、
、 的浓度由大到小的顺序是
的浓度由大到小的顺序是_______ 。
(3) 和
和 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为 ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数
_______ 。(保留2位有效数字)。
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则 +
+____ +_____ 。
| 弱电解质 | H2CO3 | NH3·H2O | |
| 电离常数 |  | 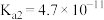 | 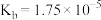 |

(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是
 、
、 、
、 、
、 的浓度由大到小的顺序是
的浓度由大到小的顺序是(3)
 和
和 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为 ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则
 +
+
您最近一年使用:0次



