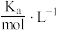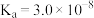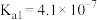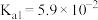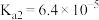名校
1 . 自然界碳的循环与 、碳酸及碳酸盐有着密切的联系。
、碳酸及碳酸盐有着密切的联系。
(1) 的空间构型为
的空间构型为___________ , 分子中σ键与π键的个数比为
分子中σ键与π键的个数比为___________ 。
(2)常温常压下,空气中 溶于水达到平衡时
溶于水达到平衡时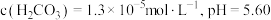 。若忽略水的电离及
。若忽略水的电离及 的第二级电离,则碳酸的一级电离常数
的第二级电离,则碳酸的一级电离常数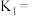
___________ (已知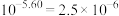 ,结果保留1位小数)。
,结果保留1位小数)。
(3)已知 的二级电离常数
的二级电离常数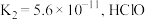 的电离常数
的电离常数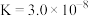 。将少量
。将少量 通入过量的
通入过量的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为___________ 。
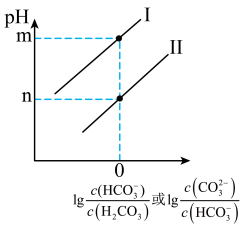
(4)在常温下向 水溶液中滴加
水溶液中滴加 溶液,所得溶液的
溶液,所得溶液的 与粒子浓度的变化关系如图。则下图中
与粒子浓度的变化关系如图。则下图中___________ 线(填“I”或“Ⅱ”)表示 ,碳酸的两级电离常数
,碳酸的两级电离常数 与
与 的关系为
的关系为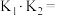
___________ (用含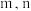 的式子表示)。
的式子表示)。
 、碳酸及碳酸盐有着密切的联系。
、碳酸及碳酸盐有着密切的联系。(1)
 的空间构型为
的空间构型为 分子中σ键与π键的个数比为
分子中σ键与π键的个数比为(2)常温常压下,空气中
 溶于水达到平衡时
溶于水达到平衡时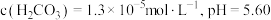 。若忽略水的电离及
。若忽略水的电离及 的第二级电离,则碳酸的一级电离常数
的第二级电离,则碳酸的一级电离常数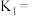
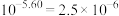 ,结果保留1位小数)。
,结果保留1位小数)。(3)已知
 的二级电离常数
的二级电离常数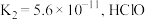 的电离常数
的电离常数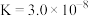 。将少量
。将少量 通入过量的
通入过量的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为(4)在常温下向
 水溶液中滴加
水溶液中滴加 溶液,所得溶液的
溶液,所得溶液的 与粒子浓度的变化关系如图。则下图中
与粒子浓度的变化关系如图。则下图中 ,碳酸的两级电离常数
,碳酸的两级电离常数 与
与 的关系为
的关系为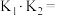
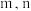 的式子表示)。
的式子表示)。
您最近一年使用:0次
2024-03-16更新
|
158次组卷
|
2卷引用:安徽省合肥市第一中学2023-2024学年高二上学期期末考试化学试题
名校
2 . 按要求完成下列内容:
(1)书写下列物质的电离方程式:
①磷酸___________ ;②氢氧化铁___________ ;③碳酸氢钠___________ ;
④明矾___________ ;⑤氢氟酸___________ ;⑥硫酸氢铵___________ 。
(2)书写下列离子方程式
①泡沫灭火器工作原理___________ 。
②碳酸氢钠溶液与过量澄清石灰水反应___________ 。
③酸性高锰酸钾溶液中通入二氧化硫气体___________ 。
(3)书写下列电化学方程式或电极反应式:
①电解法制备金属铝的总反应___________ 。
②电解精炼铜的阴极反应式___________ 。
③氯碱工业总反应___________ 。
④碱性(KOH)氢氧燃料电池的负极反应式___________ 。
(1)书写下列物质的电离方程式:
①磷酸
④明矾
(2)书写下列离子方程式
①泡沫灭火器工作原理
②碳酸氢钠溶液与过量澄清石灰水反应
③酸性高锰酸钾溶液中通入二氧化硫气体
(3)书写下列电化学方程式或电极反应式:
①电解法制备金属铝的总反应
②电解精炼铜的阴极反应式
③氯碱工业总反应
④碱性(KOH)氢氧燃料电池的负极反应式
您最近一年使用:0次
3 . 已知CH3COOH是常见的弱酸,现有常温下0.lmol·L-1的CH3COOH溶液。
(1)取0.10molCH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示。
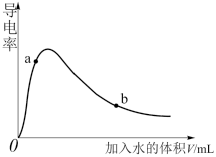
①n(H+):a___________ b(填“>”、“<”或“=”,下同)。
②c(CH3COO-):a___________ b。
③完全中和时消耗NaOH的物质的量:a___________ b。
(2)若向醋酸中加入氢氧化钠溶液,使醋酸恰好被中和,所得溶液的pH___________ 7(填“大于”“小于”或“等于”),用离子方程式表示其原因___________ ;中和后所得溶液中离子浓度由大到小的顺序为___________ 。
(3)25℃时,部分物质的电离平衡常数如表所示:
CH3COOH、H2CO3、HCN的酸性由强到弱的顺序为___________ 。
(1)取0.10molCH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示。

①n(H+):a
②c(CH3COO-):a
③完全中和时消耗NaOH的物质的量:a
(2)若向醋酸中加入氢氧化钠溶液,使醋酸恰好被中和,所得溶液的pH
(3)25℃时,部分物质的电离平衡常数如表所示:
| CH3COOH | H2CO3 | HCN |
| 1.7×10-5 | Ka1=4.3×10-7、Ka2=5.6×10-11 | 4.9×10-10 |
您最近一年使用:0次
名校
4 . 平衡思想是化学研究的一个重要观念,在电解质溶液中存在电离平衡、水解平衡、溶解平衡等多种平衡。
I.25℃时,三种弱酸的电离平衡常数如下:
回答下列问题:
(1)碳酸二级电离平衡常数的表达式为K2=___________ 。
(2)下列四种离子结合质子能力由大到小的顺序是___________。
(3)下列反应不能发生的是___________(双选)。
(4)25℃时,若测得 与
与 的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=
的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___________ mol∙L-1(填精确数值)。
(5)常温下,在醋酸溶液中加入冰醋酸,醋酸的电离度___________ ;
A.增大 B.减小 C.不变
(6)在醋酸溶液中加入一定量的醋酸钠晶体,醋酸的电离度___________ 。
A.增大 B.减小 C.不变
Ⅱ。体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如下图所示。

(7)稀释后,HX溶液中水电离出来的c(H+)___________ 醋酸溶液中水电离出来的c(H+)。
A.大于 B.等于 C.小于
(8)用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸___________ HX。
A.大于 B.等于 C.小于
I.25℃时,三种弱酸的电离平衡常数如下:
| 弱酸 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.2×10-7,K2=4.8×10-11 | 3.0×10-8 |
(1)碳酸二级电离平衡常数的表达式为K2=
(2)下列四种离子结合质子能力由大到小的顺序是___________。
A. | B. | C. | D. |
(3)下列反应不能发生的是___________(双选)。
A. |
B. |
C. |
D.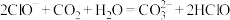 |
(4)25℃时,若测得
 与
与 的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=
的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=(5)常温下,在醋酸溶液中加入冰醋酸,醋酸的电离度
A.增大 B.减小 C.不变
(6)在醋酸溶液中加入一定量的醋酸钠晶体,醋酸的电离度
A.增大 B.减小 C.不变
Ⅱ。体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如下图所示。

(7)稀释后,HX溶液中水电离出来的c(H+)
A.大于 B.等于 C.小于
(8)用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸
A.大于 B.等于 C.小于
您最近一年使用:0次
5 . 为研究某企业冲洗电路板后的废水( ,主要含
,主要含 、
、 等)中处理铜元素的最佳pH,取5份等量的废水,分别加入
等)中处理铜元素的最佳pH,取5份等量的废水,分别加入 的
的 溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:

关于 信息:
信息:
Ⅰ. 完全沉淀的
完全沉淀的
Ⅱ.废水中存在以下平衡:
①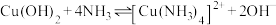 ;
;
②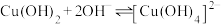
请回答下列问题
(1)结合图像可知,处理含铜废水的最佳
_____ 。
(2)该废水中含有污染环境的主要微粒除了 外,还有
外,还有_____ 。
(3)加入 溶液,使
溶液,使 转化为沉淀的离子方程式是
转化为沉淀的离子方程式是_____ 。
(4)从平衡原理分析, 段铜元素含量下降的原因是
段铜元素含量下降的原因是_____ 。
(5)分析 段,铜元素含量变化的可能原因是
段,铜元素含量变化的可能原因是_____ 。
(6)实际在加入 溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是_____ 。
 ,主要含
,主要含 、
、 等)中处理铜元素的最佳pH,取5份等量的废水,分别加入
等)中处理铜元素的最佳pH,取5份等量的废水,分别加入 的
的 溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
关于
 信息:
信息:Ⅰ.
 完全沉淀的
完全沉淀的
Ⅱ.废水中存在以下平衡:
①
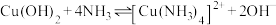 ;
;②
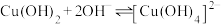
请回答下列问题
(1)结合图像可知,处理含铜废水的最佳

(2)该废水中含有污染环境的主要微粒除了
 外,还有
外,还有(3)加入
 溶液,使
溶液,使 转化为沉淀的离子方程式是
转化为沉淀的离子方程式是(4)从平衡原理分析,
 段铜元素含量下降的原因是
段铜元素含量下降的原因是(5)分析
 段,铜元素含量变化的可能原因是
段,铜元素含量变化的可能原因是(6)实际在加入
 溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
您最近一年使用:0次
6 . 利用下列价类二维图分析硫酸型酸雨的形成及防治。

(1)图中X是___________ (填化学式),从硫的化合价角度分类,X常作为___________ (填“氧化剂”或“还原剂”)。
(2)SO2是一种大气污染物,主要来源于___________ ;在降雨过程中,SO2发生转化导致雨水中含有 ,其总化学反应方程式为
,其总化学反应方程式为___________ 。
(3)从物质类别的角度判断,SO2属于___________ (填“酸性氧化物”或“碱性氧化物”);某小组用Na2CO3溶液吸收SO2,若产生CO2,则产物中硫元素的主要存在形态为___________ (写化学式)。已知该条件下亚硫酸和碳酸的电离常数为:H2SO3 K1=1.5×10-2,K2=6.0×10-8;H2CO3 K1=4.3×10-7,K2=5.6×10-11。

(1)图中X是
(2)SO2是一种大气污染物,主要来源于
 ,其总化学反应方程式为
,其总化学反应方程式为(3)从物质类别的角度判断,SO2属于
您最近一年使用:0次
解题方法
7 . 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。回答下列问题:
(1)醋酸钠溶液显___________ 性(填“酸”或“碱”),原因是___________ (用离子方程式解释)。
(2)已知某温度下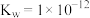 ,则该温度下
,则该温度下 的
的 溶液中,由水电离出的
溶液中,由水电离出的 为
为___________ 。
(3)常温下,某醋酸和醋酸钠的混合溶液中 ,溶液中
,溶液中 随
随 变化如图所示。
变化如图所示。

①醋酸的电离常数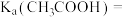
___________ , 的水解常数
的水解常数
___________ 。
②该温度下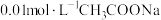 溶液的
溶液的 约为
约为___________ 。(已知 。)
。)
(1)醋酸钠溶液显
(2)已知某温度下
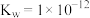 ,则该温度下
,则该温度下 的
的 溶液中,由水电离出的
溶液中,由水电离出的 为
为(3)常温下,某醋酸和醋酸钠的混合溶液中
 ,溶液中
,溶液中 随
随 变化如图所示。
变化如图所示。
①醋酸的电离常数
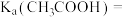
 的水解常数
的水解常数
②该温度下
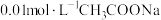 溶液的
溶液的 约为
约为 。)
。)
您最近一年使用:0次
8 . 已知,常温下,碳酸和草酸的电离常数 、
、 如下表所示:
如下表所示:
已知: 、
、
(1)常温下,在浓度均为 的四种溶液中:①
的四种溶液中:① 、②
、② 、③
、③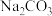 、④
、④ ,溶液中水的电离受到抑制的是
,溶液中水的电离受到抑制的是_______ (填序号,下同),溶液的 最大的是
最大的是_______ 。
(2)常温下, 草酸溶液中
草酸溶液中 、
、 、
、 的物质的量分数
的物质的量分数 随溶液
随溶液 的变化关系如图1所示[已知:
的变化关系如图1所示[已知: ],
], 或
或 与混合滂液的
与混合滂液的 的变化关系如图2所示:
的变化关系如图2所示:

①图1中的
_______ 。
②图2中直线ef纵坐标代表的是_______ [填“ ”或“
”或“ ”],其中
”],其中 点纵坐标的值为
点纵坐标的值为_______ 。
 、
、 如下表所示:
如下表所示:| 二元弱酸 |  |  |
 (简写 (简写 ) ) |  |  |
 (简写 (简写 ) ) | 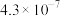 | 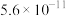 |
 、
、
(1)常温下,在浓度均为
 的四种溶液中:①
的四种溶液中:① 、②
、② 、③
、③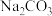 、④
、④ ,溶液中水的电离受到抑制的是
,溶液中水的电离受到抑制的是 最大的是
最大的是(2)常温下,
 草酸溶液中
草酸溶液中 、
、 、
、 的物质的量分数
的物质的量分数 随溶液
随溶液 的变化关系如图1所示[已知:
的变化关系如图1所示[已知: ],
], 或
或 与混合滂液的
与混合滂液的 的变化关系如图2所示:
的变化关系如图2所示:
①图1中的

②图2中直线ef纵坐标代表的是
 ”或“
”或“ ”],其中
”],其中 点纵坐标的值为
点纵坐标的值为
您最近一年使用:0次
9 . NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。已知:25℃时,Ka1(H2CO3)=5.0×10-7,Ka2(H2CO3)=5.0×10-11。
① 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式___________ 。NaOH溶液吸收CO2得到的某溶液中。当c( ):c(
):c( )=2:1时,溶液的
)=2:1时,溶液的
___________ 。
②泡沫灭火器中通常装有NaHCO3溶液和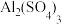 溶液,请写出这两种溶液混合时的离子反应方程式
溶液,请写出这两种溶液混合时的离子反应方程式___________ 。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NaOH+ 2NO2= NaNO3+ NaNO2+H2O。含 的水溶液与
的水溶液与 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 溶液,则两份溶液中c(
溶液,则两份溶液中c( )、c(
)、c( )和
)和 由大到小的顺序为
由大到小的顺序为___________ (已知HNO2的电离常数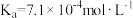 ,CH3COOH的电离常数
,CH3COOH的电离常数 。可使溶液A和溶液B的
。可使溶液A和溶液B的 相等的方法是
相等的方法是___________ (填序号)。
A.向溶液A中加适量NaOH B.向溶液A中加适量水 C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收SO2的过程中,常温下,溶液中H2SO3、 、
、 三者所占物质的量分数
三者所占物质的量分数 随
随 变化的关系如图所示:
变化的关系如图所示:

①由上图可以判断H2SO3的Ka1=___________ 。
②图中pH=7时,溶液中离子浓度关系正确的是___________ 。
A.
B.
C.
D. c(H+)=c(OH-)
c(H+)=c(OH-)
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。已知:25℃时,Ka1(H2CO3)=5.0×10-7,Ka2(H2CO3)=5.0×10-11。
①
 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式 ):c(
):c( )=2:1时,溶液的
)=2:1时,溶液的
②泡沫灭火器中通常装有NaHCO3溶液和
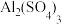 溶液,请写出这两种溶液混合时的离子反应方程式
溶液,请写出这两种溶液混合时的离子反应方程式(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NaOH+ 2NO2= NaNO3+ NaNO2+H2O。含
 的水溶液与
的水溶液与 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 溶液,则两份溶液中c(
溶液,则两份溶液中c( )、c(
)、c( )和
)和 由大到小的顺序为
由大到小的顺序为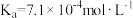 ,CH3COOH的电离常数
,CH3COOH的电离常数 。可使溶液A和溶液B的
。可使溶液A和溶液B的 相等的方法是
相等的方法是A.向溶液A中加适量NaOH B.向溶液A中加适量水 C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收SO2的过程中,常温下,溶液中H2SO3、
 、
、 三者所占物质的量分数
三者所占物质的量分数 随
随 变化的关系如图所示:
变化的关系如图所示:
①由上图可以判断H2SO3的Ka1=
②图中pH=7时,溶液中离子浓度关系正确的是
A.

B.

C.

D.
 c(H+)=c(OH-)
c(H+)=c(OH-)
您最近一年使用:0次
名校
10 . 表是25℃时某些弱酸的电离平衡常数。
(1)pH相同的NaClO和 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
______ NaClO(填“ ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
______  。
。
(2)若
 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
______ 。
(3)取10mL 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中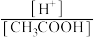 的比值将
的比值将______ (填“增大”“减小”或“无法确定”)。
(4)向碳酸钠溶液中滴加少量氯水的离子方程式______ 。
化学式 |
|
|
|
|
|
|
|
|
|
 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
 ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
 。
。(2)若

 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
(3)取10mL
 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中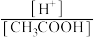 的比值将
的比值将(4)向碳酸钠溶液中滴加少量氯水的离子方程式
您最近一年使用:0次