2024高三下·全国·专题练习
1 . 已知Ka(Kb)、Kw、Kh、Ksp分别表示弱酸的电离平衡常数(弱碱的电离平衡常数)、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq) Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=___________ ,并据此推断Mg(OH)2___________ (填“能”或“不能”)溶解于醋酸(已知1.83≈5.8)。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)
 Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
您最近一年使用:0次
2024高三下·全国·专题练习
2 . 硫及其化合物在日常生活、工业生产中都非常普遍。
(1)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++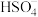 ,
,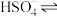 H++
H++ 。
。
①25℃时,Na2SO4溶液的pH___________ (填“>”“<”或“=”)7。
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数___________ (写出计算过程,结果保留三位有效数字)。
(2)液态水中,水存在自偶电离:H2O+H2O H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为___________ 。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是___________ 。若保持温度不变,关于该所得溶液,下列说法正确的是___________ 。
A.加入少量冰醋酸,c(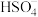 )与c(
)与c( )均减小
)均减小
B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c(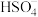 )与c(
)与c( )的比值减小
)的比值减小
D.加入少量Na2SO4固体,c(Ac-)减小
(1)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++
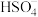 ,
,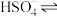 H++
H++ 。
。①25℃时,Na2SO4溶液的pH
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数
(2)液态水中,水存在自偶电离:H2O+H2O
 H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是
A.加入少量冰醋酸,c(
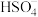 )与c(
)与c( )均减小
)均减小B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c(
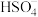 )与c(
)与c( )的比值减小
)的比值减小D.加入少量Na2SO4固体,c(Ac-)减小
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物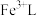 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;②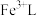 的再生。反应原理如下:
的再生。反应原理如下:
①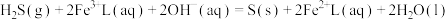

②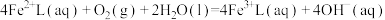
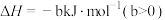
回答下列问题:
(1) 的电离方程式为
的电离方程式为___________ 。25℃时, 溶液中
溶液中 、
、 、
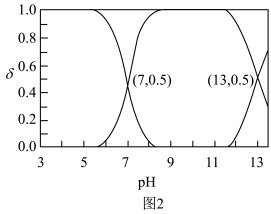
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的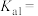
___________ ,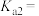
___________ 。再生反应在常温下进行,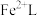 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的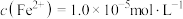 ,
,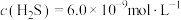 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于___________ (已知25℃时,FeS的 为
为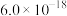 )。
)。
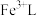 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;②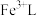 的再生。反应原理如下:
的再生。反应原理如下:①
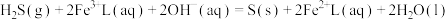

②
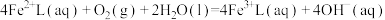
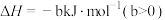
回答下列问题:
(1)
 的电离方程式为
的电离方程式为 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的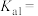
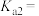
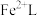 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的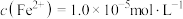 ,
,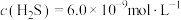 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于 为
为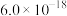 )。
)。
您最近一年使用:0次
2024高三下·全国·专题练习
4 . 一定条件下,水气变换反应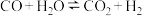 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
I.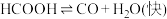
II.
研究发现,在反应I、II中, 仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)反应I正反应速率方程为: ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为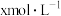 时,
时, 浓度为
浓度为___________  ,此时反应I的反应速率
,此时反应I的反应速率
___________  (用含
(用含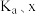 和k的代数式表示)。
和k的代数式表示)。
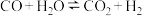 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:I.
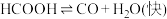
II.

研究发现,在反应I、II中,
 仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:(1)反应I正反应速率方程为:
 ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为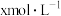 时,
时, 浓度为
浓度为 ,此时反应I的反应速率
,此时反应I的反应速率
 (用含
(用含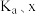 和k的代数式表示)。
和k的代数式表示)。
您最近一年使用:0次
5 . 一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究
CO2+H2的中间产物是HCOOH。为探究该反应过程,研究 水溶液在密封石英管中的分子反应:
水溶液在密封石英管中的分子反应:
Ⅰ.HCOOH CO+H2O(快)
CO+H2O(快)
Ⅱ.HCOOH CO2+H2(慢)
CO2+H2(慢)
反应Ⅰ正反应速率方程为: ,k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为xmol·L-1时,H+浓度为
,k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为xmol·L-1时,H+浓度为______ mol·L-1,此时反应Ⅰ应速率
______ mol·L-1·h-1(用含Ka、x和k的代数式表示)。
 CO2+H2的中间产物是HCOOH。为探究该反应过程,研究
CO2+H2的中间产物是HCOOH。为探究该反应过程,研究 水溶液在密封石英管中的分子反应:
水溶液在密封石英管中的分子反应:Ⅰ.HCOOH
 CO+H2O(快)
CO+H2O(快)Ⅱ.HCOOH
 CO2+H2(慢)
CO2+H2(慢)反应Ⅰ正反应速率方程为:
 ,k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为xmol·L-1时,H+浓度为
,k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为xmol·L-1时,H+浓度为
您最近一年使用:0次
6 . 弱酸HA的电离常数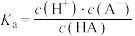 。25℃时,几种弱酸的电离常数如下:
。25℃时,几种弱酸的电离常数如下:
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ 。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)___________ v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:
___________  。
。
③将0.2mol/LHCN溶液与0.1mol/L Na2CO3溶液等体积混合,发生反应的离子方程式为_______ 。
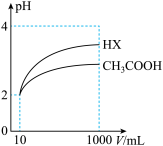
(2)体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)比醋酸溶液中水电离的c(H+)___________ ;电离常数
___________ 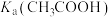 (填“>”、“=”或“<”),理由是
(填“>”、“=”或“<”),理由是_________ 。
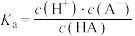 。25℃时,几种弱酸的电离常数如下:
。25℃时,几种弱酸的电离常数如下:| 弱酸化学式 |  |  | HCN |  |
| 电离常数 | 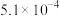 | 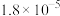 | 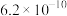 | 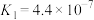  |
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)

 。
。③将0.2mol/LHCN溶液与0.1mol/L Na2CO3溶液等体积混合,发生反应的离子方程式为
(2)体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)比醋酸溶液中水电离的c(H+)

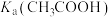 (填“>”、“=”或“<”),理由是
(填“>”、“=”或“<”),理由是
您最近一年使用:0次
名校
解题方法
7 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)25℃时,在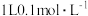 的HA溶液中,有
的HA溶液中,有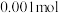 的HA电离成离子,则该温度下的电离平衡常数为
的HA电离成离子,则该温度下的电离平衡常数为_______ 。
(2)在25℃时,将pH=11的 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液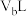 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。
(3)常温下将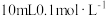 的NaOH溶液与
的NaOH溶液与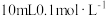 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为_______ 。
(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
①酸性由强到弱的顺序为_______ ;
②将少量的 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:_______ 。
(5)已知25℃时,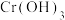 的溶度积常数
的溶度积常数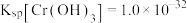 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中 时;应调节pH的最小值a为多少
时;应调节pH的最小值a为多少_______ 。
(6)在 的
的 溶液中,下列粒子浓度关系式正确的是_______(填字母)。
溶液中,下列粒子浓度关系式正确的是_______(填字母)。
(7)已知在25℃时,将浓度相等的HF与NaF溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因_______ 。
(1)25℃时,在
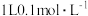 的HA溶液中,有
的HA溶液中,有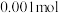 的HA电离成离子,则该温度下的电离平衡常数为
的HA电离成离子,则该温度下的电离平衡常数为(2)在25℃时,将pH=11的
 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液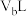 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。(3)常温下将
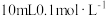 的NaOH溶液与
的NaOH溶液与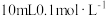 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
| 化学式 |  | 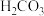 |  |  |
| 电离平衡常数 | 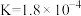 | 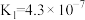 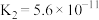 |  | 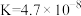 |
②将少量的
 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:(5)已知25℃时,
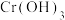 的溶度积常数
的溶度积常数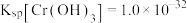 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中 时;应调节pH的最小值a为多少
时;应调节pH的最小值a为多少(6)在
 的
的 溶液中,下列粒子浓度关系式正确的是_______(填字母)。
溶液中,下列粒子浓度关系式正确的是_______(填字母)。A.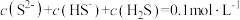 |
B. |
C. |
D.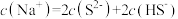 |
您最近一年使用:0次
8 . 水溶液中存在着多种平衡,按要求回答下列问题。
(1)常温下,0.1 mol/L的一元弱酸HA,加水稀释过程中,溶液的pH将_______ (填“增大”、“减小”或“不变”,下同),HA的电离度_______ ,HA的电离平衡常数(K)将_______ 。
(2)常温下,向10 mL 0.2 mol/L的草酸(H2C2O4,二元弱酸)溶液中加入0.1 mol/L的NaOH溶液30 mL,则2c(OH-)+c( )- 2c(H+)=
)- 2c(H+)=_______ (用微粒的物质的量浓度符号表示)。若此时溶液的pH=4.5,则溶液中水的电离程度_______ (填“>”、“<”、“=”或“无法判断”)纯水的电离程度。
(3)已知常温下Fe(OH)3的Ksp=2.7×10-39,lg3=0.48。试计算0.1 mol/L的FeCl3溶液中,Fe3+开始生成沉淀时的pH=_______ 。
(1)常温下,0.1 mol/L的一元弱酸HA,加水稀释过程中,溶液的pH将
(2)常温下,向10 mL 0.2 mol/L的草酸(H2C2O4,二元弱酸)溶液中加入0.1 mol/L的NaOH溶液30 mL,则2c(OH-)+c(
 )- 2c(H+)=
)- 2c(H+)=(3)已知常温下Fe(OH)3的Ksp=2.7×10-39,lg3=0.48。试计算0.1 mol/L的FeCl3溶液中,Fe3+开始生成沉淀时的pH=
您最近一年使用:0次
2023-02-14更新
|
154次组卷
|
3卷引用:溶液中的离子平衡
9 . 现有下列物质 ①熔化的NaCl ②盐酸 ③氯气 ④冰醋酸 ⑤铜 ⑥酒精 ⑦硫酸氢钠 ⑧液氨 ⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于弱电解质的是_______ (填序号)
(4)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
(5)可以证明④是弱酸的事实是_______(填序号)
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为_______ (用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为_______ 。
(7)常温下,有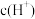 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示醋酸)
a.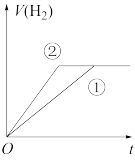 b.
b. 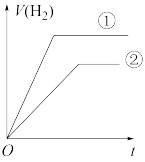 c.
c. 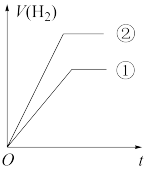 d.
d. 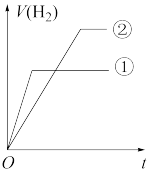
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于弱电解质的是
(4)属于非电解质,但溶于水后的水溶液能导电的是
(5)可以证明④是弱酸的事实是_______(填序号)
| A.乙酸和水能以任意比例混溶 |
| B.在乙酸水溶液中含有未电离的乙酸分子 |
| C.乙酸与Na2CO3溶液反应放出CO2气体 |
| D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色 |
(7)常温下,有
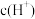 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是a.
 b.
b.  c.
c.  d.
d. 
您最近一年使用:0次
2022-12-06更新
|
532次组卷
|
7卷引用:1.2.1 电解质及其电离(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)
(已下线)1.2.1 电解质及其电离(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题(已下线)3.1.1 电离平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省武汉市武钢三中2022-2023学年高二上学期第一次月考化学试题广东省清远市四校联盟2022-2023学年高二上学期期中考试化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
10 . 常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___ 。
(2)溶液②呈______ (填“酸”“碱”或“中”)性。其原因是___ (用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____ (填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c(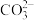 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)____ c(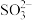 )
)
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH
(2)溶液②呈
(3)下列有关①和②两种溶液的说法正确的是
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)
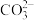 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)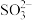 )
)
您最近一年使用:0次
2022-12-05更新
|
581次组卷
|
9卷引用:专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)
(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)江苏省海安市2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题



