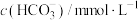1 . 氯化磷酸三钠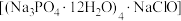 具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为
具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为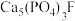 ,含杂质
,含杂质 、
、 等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
b.常温下 的
的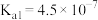 ,
,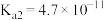 ;
; 。
。
c.常温下,磷酸中含磷微粒分布分数[如 的分布分数表示为
的分布分数表示为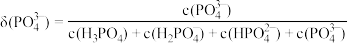 ]与pH的关系如下图所示:
]与pH的关系如下图所示:___________ 。
(2)常温下,“中和Ⅰ”应控制的pH约为___________ , 的
的
___________ 。
(3)“中和Ⅱ”不用 溶液,其原因是
溶液,其原因是___________ 。
(4)“合成”过程中两种溶液混合后需快速冷却,原因是___________ ;“系列操作”中包含“蒸发浓缩、冷却结晶、过滤、洗涤、干燥”,干燥时需控制温度不超过60℃的原因是___________ 。母液可以进入___________ (填操作单元名称)进行循环利用。
 具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为
具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为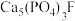 ,含杂质
,含杂质 、
、 等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题: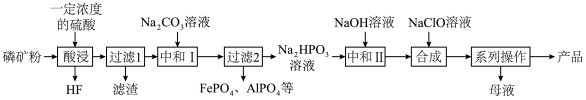
b.常温下
 的
的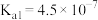 ,
,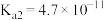 ;
; 。
。c.常温下,磷酸中含磷微粒分布分数[如
 的分布分数表示为
的分布分数表示为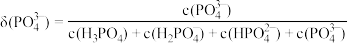 ]与pH的关系如下图所示:
]与pH的关系如下图所示: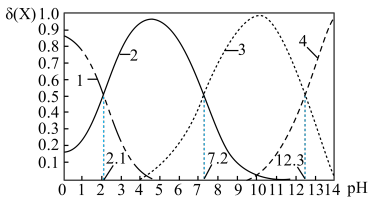
(2)常温下,“中和Ⅰ”应控制的pH约为
 的
的
(3)“中和Ⅱ”不用
 溶液,其原因是
溶液,其原因是(4)“合成”过程中两种溶液混合后需快速冷却,原因是
您最近一年使用:0次
名校
解题方法
2 . 一种锂离子电池的工作原理: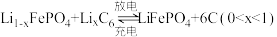 。从废旧电池再生
。从废旧电池再生 的一种流程如下,
的一种流程如下,
负极: 。
。
正极:_______ 。
(2)为保证正极材料在空气中充分反应,可采取的措施是_______ (答一条即可)。
(3)向浸出液中加入氨水调节溶液pH,有沉淀生成。pH对沉淀中Fe和P的物质的量之比 的影响如图所示。
的影响如图所示。 分别与
分别与 、
、 、
、 形成的化合物均难溶于水。
形成的化合物均难溶于水。
ii. 体系中含磷粒子的物质的量分数与pH的关系如图所示。
体系中含磷粒子的物质的量分数与pH的关系如图所示。 沉淀的最佳
沉淀的最佳 在
在_______ 左右。
②当 时,沉淀中一定有的含铁物质是
时,沉淀中一定有的含铁物质是 和
和_______ (填化学式)。
③若向 的浊液中继续加入氨水至
的浊液中继续加入氨水至 ,会导致
,会导致 的值增大,主要反应的化学方程式是
的值增大,主要反应的化学方程式是_______ 。
(4)下列关于该流程的说法正确的是_______(填序号)。
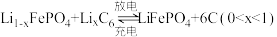 。从废旧电池再生
。从废旧电池再生 的一种流程如下,
的一种流程如下,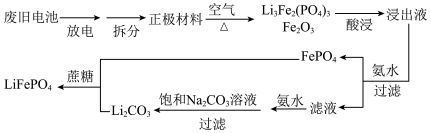
负极:
 。
。正极:
(2)为保证正极材料在空气中充分反应,可采取的措施是
(3)向浸出液中加入氨水调节溶液pH,有沉淀生成。pH对沉淀中Fe和P的物质的量之比
 的影响如图所示。
的影响如图所示。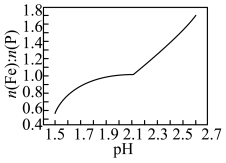
 分别与
分别与 、
、 、
、 形成的化合物均难溶于水。
形成的化合物均难溶于水。ii.
 体系中含磷粒子的物质的量分数与pH的关系如图所示。
体系中含磷粒子的物质的量分数与pH的关系如图所示。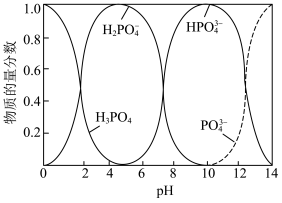
 沉淀的最佳
沉淀的最佳 在
在②当
 时,沉淀中一定有的含铁物质是
时,沉淀中一定有的含铁物质是 和
和③若向
 的浊液中继续加入氨水至
的浊液中继续加入氨水至 ,会导致
,会导致 的值增大,主要反应的化学方程式是
的值增大,主要反应的化学方程式是(4)下列关于该流程的说法正确的是_______(填序号)。
A.正极材料在空气中加热,理论上生成的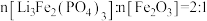 |
B.当浸出液的pH从0增大为2时,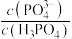 的值增大了 的值增大了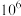 倍 倍 |
C.向滤液中加入氨水,可减少饱和 溶液的用量 溶液的用量 |
D.由 和 和 再生 再生 时,所加的蔗糖作氧化剂 时,所加的蔗糖作氧化剂 |
您最近一年使用:0次
名校
解题方法
3 . 二氧化铈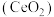 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)“氧化焙烧”中氧化的目的是___________ 。
(2)“酸浸”时提高浸取率的方法___________ (写出一种)。
(3)“萃取”时存在反应: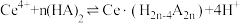 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为___________ (填标号);硫酸浓度过大时,萃取率降低的原因是___________ 。
(4)“反萃取”中,在稀硫酸和 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:___________ 。
(5)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于___________ 时, 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
(6)二氧化铈( )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物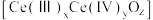 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为___________ ,当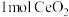 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为___________ 。
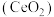 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 能与
能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)“氧化焙烧”中氧化的目的是
(2)“酸浸”时提高浸取率的方法
(3)“萃取”时存在反应:
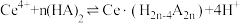 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
(4)“反萃取”中,在稀硫酸和
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(5)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)(6)二氧化铈(
 )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物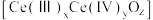 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为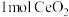 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为
您最近一年使用:0次
4 . 硫酸盐(含 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: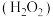 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。
① 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生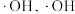 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:
反应Ⅰ: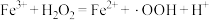 (慢反应);
(慢反应);
反应Ⅱ: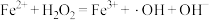 (快反应).
(快反应).
下列说法正确的是________ (填选项字母)。
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气, 氧化
氧化 的反应速率加快
的反应速率加快
D.与 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高
②研究表明 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:
Ⅰ.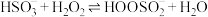 ;
;
Ⅱ.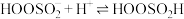 ;
;
Ⅲ.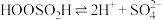 。
。
由此可判断,该条件下的 值为
值为__________ (填“ ”“
”“ ”或“
”或“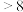 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:____________ 。
(2) 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
Ⅰ.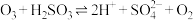 ;
;
Ⅱ. ;
;
Ⅲ.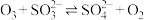 。
。
在含硫微粒总的物质的量为 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得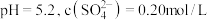 ,则
,则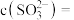
____________ (保留两位有效数字,请写出计算过程)。
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示: 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠________________ 形成;写出 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:____________________ 。
②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是________________ 。
 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: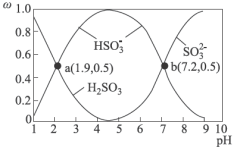
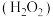 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。①
 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生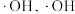 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:反应Ⅰ:
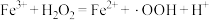 (慢反应);
(慢反应);反应Ⅱ:
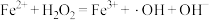 (快反应).
(快反应).下列说法正确的是
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气,
 氧化
氧化 的反应速率加快
的反应速率加快D.与
 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高②研究表明
 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:Ⅰ.
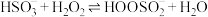 ;
;Ⅱ.
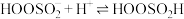 ;
;Ⅲ.
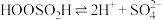 。
。由此可判断,该条件下的
 值为
值为 ”“
”“ ”或“
”或“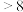 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:(2)
 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:Ⅰ.
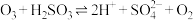 ;
;Ⅱ.
 ;
;Ⅲ.
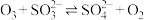 。
。在含硫微粒总的物质的量为
 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得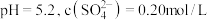 ,则
,则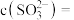
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示:
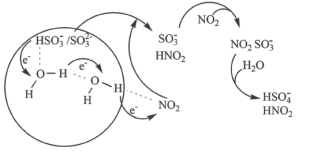
 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是
您最近一年使用:0次
2024-05-24更新
|
131次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
解题方法
5 . 二氧化硫是一种使人们爱恨交加的物质,爱其作为一种化工原料,为人类提供物质基础,恨其有毒,对人类即环境的危害。联系工业生产中用碱液吸收含 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: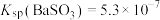 。
。
(1)利用85%的浓硫酸和 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。
(2) 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。
某同学查阅资料:常温时, ,
,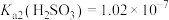 。
。
某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是________ (填微粒化学式)。
(3)“性质实验装置”中将 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀:________________ ;有同学结合“性质实验”反应物的组成及性质推断该沉淀为 ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是________________ 。请你设计实验探究该反应的生成物是 ,而不是
,而不是 :
:________________ 。
(4)在“性质实验装置”中制备少量硫代硫酸钠( ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为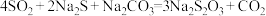 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中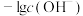 、
、 的质量变化关系如下图:
的质量变化关系如下图: 的生成量曲线为
的生成量曲线为________ (填“甲”或“乙”),曲线乙Q点后出现急剧下降的原因是________ 。
(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用________ 。
 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: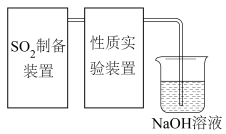
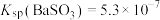 。
。(1)利用85%的浓硫酸和
 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。A.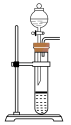 | B. | C.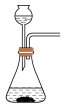 | D.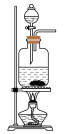 |
(2)
 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。某同学查阅资料:常温时,
 ,
,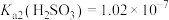 。
。某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的
 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是(3)“性质实验装置”中将
 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀: ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是 ,而不是
,而不是 :
:(4)在“性质实验装置”中制备少量硫代硫酸钠(
 ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为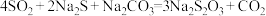 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中 、
、 的质量变化关系如下图:
的质量变化关系如下图: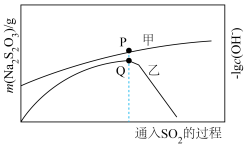
 的生成量曲线为
的生成量曲线为(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用
您最近一年使用:0次
6 . 某小组探秘人体血液中的运载氧平衡及酸碱平衡,回答下列问题:
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:
ⅰ.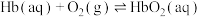

ⅱ.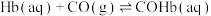

ⅱ.

ⅳ.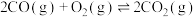

(1)
________ (用含a、b或c的代数式表示)。
(2) 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。
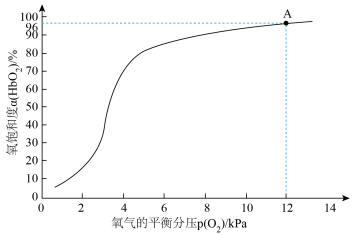
(3)36.5℃时,氧饱和度[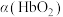 ,
,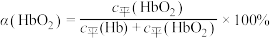 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
____________________ (写出计算过程;氧气的平衡浓度可用氧气的平衡分压代替)。
正常人体血液中主要含有 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
(4)37℃时 的水解常数
的水解常数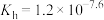 ,
,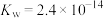 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式___________ ;请判断该同学血液的pH是否正常________ 。(填“是”或“否”)
(5)人体酸碱平衡维持机制简要表达如下图: 会
会__________ (选填“增加”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法__________ 。(选填字母)
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5% 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合
 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:ⅰ.
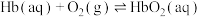

ⅱ.
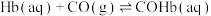

ⅱ.


ⅳ.
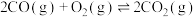

(1)

(2)
 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。A.当 不变时,反应达到平衡 不变时,反应达到平衡 | B.若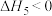 ,则该反应任意温度下能自发 ,则该反应任意温度下能自发 |
C.高氧条件下,血液中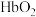 浓度增加 浓度增加 | D.人体代谢酸增加,该反应K值变大 |
(3)36.5℃时,氧饱和度[
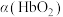 ,
,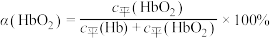 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
正常人体血液中主要含有
 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:项目名称 | 结果浓度 | 参考范围 | |
正常人 | 代谢性酸中毒病人 | ||
| 40 | 50 | 35~45 |
| 24.2 | 19 | 23.3~24.8 |
血液酸碱度(pH) | 7.40 | 7.21 | 7.35~7.45 |
(4)37℃时
 的水解常数
的水解常数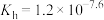 ,
,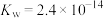 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式(5)人体酸碱平衡维持机制简要表达如下图:
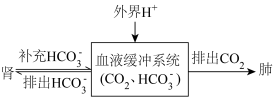
 会
会②对于重度代谢性酸中毒的病人应该采用什么治疗方法
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%
 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
您最近一年使用:0次
解题方法
7 . 氯碱厂制备的原盐中含有的杂质主要为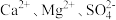 及大分子有机物和难溶性泥沙等物质。为供给电解槽以合格的盐水,可采用以下工艺流程精制盐水。
及大分子有机物和难溶性泥沙等物质。为供给电解槽以合格的盐水,可采用以下工艺流程精制盐水。 的电离常数
的电离常数
(1)溶浸工序中,以下除杂试剂:①过量的 ②过量的
②过量的 ③过量的
③过量的 ,正确的加入顺序为
,正确的加入顺序为_____ 。
A.②①③ B.③①② C.①③②
(2)在脱氯工序中加入 除去游离的氯的离子方程式为
除去游离的氯的离子方程式为_____ 。
(3)用 溶液吸收一定量
溶液吸收一定量 气体形成
气体形成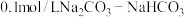 缓冲溶液,
缓冲溶液, 时,溶液中
时,溶液中
_____ 。
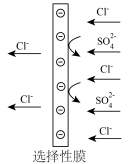
(4)利用膜的选择性,可除去脱氯过程中引入的 ,通过“错流”方式截留下
,通过“错流”方式截留下 ,使
,使 以渗透液的形式输送到后续工序。不同膜对介质的截留率,相关离子系数如下表:
以渗透液的形式输送到后续工序。不同膜对介质的截留率,相关离子系数如下表:
最好的选择是_____ 膜,该膜脱硫率高的原因是_____ 。
(5)一种镧镍储氢合金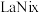 晶体的结构单元如图所示,“电解2”产生的
晶体的结构单元如图所示,“电解2”产生的 与其结合后形成
与其结合后形成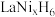 (
( 进入合金后解离成氢原子并填充在晶胞空隙中,晶胞体积不变)。
进入合金后解离成氢原子并填充在晶胞空隙中,晶胞体积不变)。 中,
中,
_____ , 的配位数为
的配位数为_____ 。
② 该合金可以储存
该合金可以储存_____ 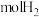 。
。
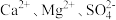 及大分子有机物和难溶性泥沙等物质。为供给电解槽以合格的盐水,可采用以下工艺流程精制盐水。
及大分子有机物和难溶性泥沙等物质。为供给电解槽以合格的盐水,可采用以下工艺流程精制盐水。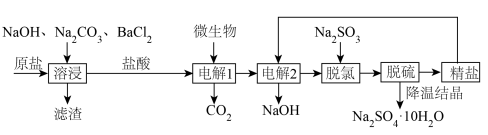
 的电离常数
的电离常数
(1)溶浸工序中,以下除杂试剂:①过量的
 ②过量的
②过量的 ③过量的
③过量的 ,正确的加入顺序为
,正确的加入顺序为A.②①③ B.③①② C.①③②
(2)在脱氯工序中加入
 除去游离的氯的离子方程式为
除去游离的氯的离子方程式为(3)用
 溶液吸收一定量
溶液吸收一定量 气体形成
气体形成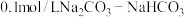 缓冲溶液,
缓冲溶液, 时,溶液中
时,溶液中
(4)利用膜的选择性,可除去脱氯过程中引入的
 ,通过“错流”方式截留下
,通过“错流”方式截留下 ,使
,使 以渗透液的形式输送到后续工序。不同膜对介质的截留率,相关离子系数如下表:
以渗透液的形式输送到后续工序。不同膜对介质的截留率,相关离子系数如下表:| 截留率 物质 | 反渗透膜(%) | 纳滤膜(%) | 超滤膜(%) |
|
 | 99 | 15.6 | 0 | |
 | 99 | 99 | 0 | |
| 系数 离子 | 水合离子半径 | 扩散系数/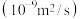 | ||
 | 0.397 | 1.065 | ||
 | 0.332 | 2.032 | ||
(5)一种镧镍储氢合金
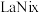 晶体的结构单元如图所示,“电解2”产生的
晶体的结构单元如图所示,“电解2”产生的 与其结合后形成
与其结合后形成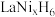 (
( 进入合金后解离成氢原子并填充在晶胞空隙中,晶胞体积不变)。
进入合金后解离成氢原子并填充在晶胞空隙中,晶胞体积不变)。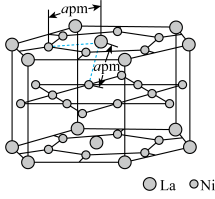
 中,
中,
 的配位数为
的配位数为②
 该合金可以储存
该合金可以储存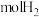 。
。
您最近一年使用:0次
名校
8 . 三价砷毒性很强,其废水需要处理后才能排放。
Ⅰ.常温下,用 溶液滴定
溶液滴定 时,①~④四种含砷微粒的物质的量分数随
时,①~④四种含砷微粒的物质的量分数随 的变化曲线如图所示,其中
的变化曲线如图所示,其中 、
、 、
、 、
、 四点的横坐标分别为
四点的横坐标分别为 、
、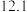 、
、 和
和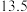 。
。 的
的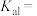
_____ 。
(2)结合化学用语解释 溶液显碱性的原因
溶液显碱性的原因_____ 。
(3)下列说法正确的是_____ 。(填字母)
A. 点的溶液中,
点的溶液中,
B. 在12~14之间,随
在12~14之间,随 增大,
增大,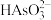 电离程度增大,
电离程度增大, 减小
减小
C.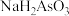 溶液中,
溶液中,
Ⅱ.用化学沉降法处理酸性含砷废水的工艺流程如下: 与过量的
与过量的 存在反应:
存在反应: ;
; 
(4)用平衡移动原理解释加入 的作用是
的作用是_____ 。
(5)写出 与含砷物质反应的化学方程式
与含砷物质反应的化学方程式_____ 。
(6)沉淀 为
为_____ 。
(7)含砷废水允许排放标准为 。若低浓度含砷废水(假设砷均以
。若低浓度含砷废水(假设砷均以 形式存在)中
形式存在)中 的浓度为
的浓度为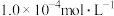 ,定量说明该含砷废水是否符合排放标准
,定量说明该含砷废水是否符合排放标准_____ 。
Ⅰ.常温下,用
 溶液滴定
溶液滴定 时,①~④四种含砷微粒的物质的量分数随
时,①~④四种含砷微粒的物质的量分数随 的变化曲线如图所示,其中
的变化曲线如图所示,其中 、
、 、
、 、
、 四点的横坐标分别为
四点的横坐标分别为 、
、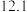 、
、 和
和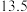 。
。
 的
的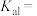
(2)结合化学用语解释
 溶液显碱性的原因
溶液显碱性的原因(3)下列说法正确的是
A.
 点的溶液中,
点的溶液中,
B.
 在12~14之间,随
在12~14之间,随 增大,
增大,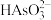 电离程度增大,
电离程度增大, 减小
减小C.
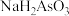 溶液中,
溶液中,
Ⅱ.用化学沉降法处理酸性含砷废水的工艺流程如下:

 与过量的
与过量的 存在反应:
存在反应: ;
; 
(4)用平衡移动原理解释加入
 的作用是
的作用是(5)写出
 与含砷物质反应的化学方程式
与含砷物质反应的化学方程式(6)沉淀
 为
为(7)含砷废水允许排放标准为
 。若低浓度含砷废水(假设砷均以
。若低浓度含砷废水(假设砷均以 形式存在)中
形式存在)中 的浓度为
的浓度为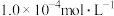 ,定量说明该含砷废水是否符合排放标准
,定量说明该含砷废水是否符合排放标准
您最近一年使用:0次
2024-01-21更新
|
152次组卷
|
3卷引用:北京市丰台区2023-2024学年高二上学期期末考试化学试题
9 . 完成下列问题。
I.
(1)已知 ,
, 的
的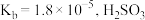 的
的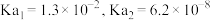 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的 约为
约为___________  。将
。将 通入该氨水中,当
通入该氨水中,当 下降至
下降至 时,溶液中
时,溶液中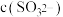 和
和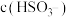 的比值是
的比值是___________ 。
Ⅱ. 是最重要的温室气体之一,其过量排放在导致全球各种变化的诱因中扮演了重要角色,近年来如何降低大气中
是最重要的温室气体之一,其过量排放在导致全球各种变化的诱因中扮演了重要角色,近年来如何降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,正成为科学家研究的主要课题。利用
,正成为科学家研究的主要课题。利用 和
和 合成甲醇,涉及的主要反应如下:
合成甲醇,涉及的主要反应如下:
反应Ⅰ: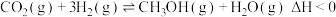
反应Ⅱ:
回答下列问题:
(2)反应Ⅰ自发进行的条件是___________ (填“低温”或“高温”或“任何温度”)。
(3)在体积不变的密闭容器中,充入 和
和 发生反应Ⅱ,当下列条件不再变化时,能说明反应达到平衡状态的有
发生反应Ⅱ,当下列条件不再变化时,能说明反应达到平衡状态的有___________ 。
A. 的浓度不变 B.
的浓度不变 B. 的质量不变 C.容器内气体的总压强
的质量不变 C.容器内气体的总压强
D.容器内混合气体的密度 E.容器内混合气体的平均摩尔质量
(4)一定条件下,在容积为VL的密闭容器中充入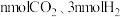 发生反应Ⅰ,反应达到平衡时,反应物的转化率关系是
发生反应Ⅰ,反应达到平衡时,反应物的转化率关系是
___________  (填“>”“<”或“=”),下列措施中能等同时满足增大反应速率和提高
(填“>”“<”或“=”),下列措施中能等同时满足增大反应速率和提高 转化率的是
转化率的是___________ 。
A.使用高效催化利 B.降低反应温度
C.将容器体积缩小为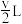 D.不断将甲醇从反应混合物中分离出来
D.不断将甲醇从反应混合物中分离出来
(5)在 密闭容器中通入
密闭容器中通入 和
和 ,选择合适的催化剂反应,甲醇的选择率(生成甲醇的
,选择合适的催化剂反应,甲醇的选择率(生成甲醇的 占
占 总转化量的物质的量分数)和
总转化量的物质的量分数)和 的平衡转化率随温度的变化趋势如下图所示。
的平衡转化率随温度的变化趋势如下图所示。
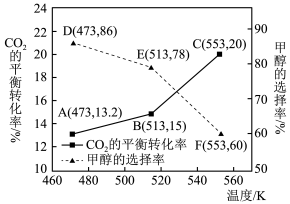
①达到平衡时,反应体系内甲醇的产量最高的是___________ (填“D”、“E”或“F”)。
② 时,反应Ⅰ的平衡常数K=
时,反应Ⅰ的平衡常数K=___________ 。
③随着温度的升高,甲醇的选择率降低, 的平衡转化率升高,其原因为
的平衡转化率升高,其原因为___________ 。
I.
(1)已知
 ,
, 的
的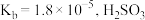 的
的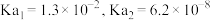 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的 约为
约为 。将
。将 通入该氨水中,当
通入该氨水中,当 下降至
下降至 时,溶液中
时,溶液中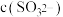 和
和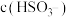 的比值是
的比值是Ⅱ.
 是最重要的温室气体之一,其过量排放在导致全球各种变化的诱因中扮演了重要角色,近年来如何降低大气中
是最重要的温室气体之一,其过量排放在导致全球各种变化的诱因中扮演了重要角色,近年来如何降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,正成为科学家研究的主要课题。利用
,正成为科学家研究的主要课题。利用 和
和 合成甲醇,涉及的主要反应如下:
合成甲醇,涉及的主要反应如下:反应Ⅰ:
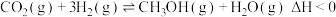
反应Ⅱ:

回答下列问题:
(2)反应Ⅰ自发进行的条件是
(3)在体积不变的密闭容器中,充入
 和
和 发生反应Ⅱ,当下列条件不再变化时,能说明反应达到平衡状态的有
发生反应Ⅱ,当下列条件不再变化时,能说明反应达到平衡状态的有A.
 的浓度不变 B.
的浓度不变 B. 的质量不变 C.容器内气体的总压强
的质量不变 C.容器内气体的总压强D.容器内混合气体的密度 E.容器内混合气体的平均摩尔质量
(4)一定条件下,在容积为VL的密闭容器中充入
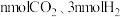 发生反应Ⅰ,反应达到平衡时,反应物的转化率关系是
发生反应Ⅰ,反应达到平衡时,反应物的转化率关系是
 (填“>”“<”或“=”),下列措施中能等同时满足增大反应速率和提高
(填“>”“<”或“=”),下列措施中能等同时满足增大反应速率和提高 转化率的是
转化率的是A.使用高效催化利 B.降低反应温度
C.将容器体积缩小为
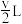 D.不断将甲醇从反应混合物中分离出来
D.不断将甲醇从反应混合物中分离出来(5)在
 密闭容器中通入
密闭容器中通入 和
和 ,选择合适的催化剂反应,甲醇的选择率(生成甲醇的
,选择合适的催化剂反应,甲醇的选择率(生成甲醇的 占
占 总转化量的物质的量分数)和
总转化量的物质的量分数)和 的平衡转化率随温度的变化趋势如下图所示。
的平衡转化率随温度的变化趋势如下图所示。
①达到平衡时,反应体系内甲醇的产量最高的是
②
 时,反应Ⅰ的平衡常数K=
时,反应Ⅰ的平衡常数K=③随着温度的升高,甲醇的选择率降低,
 的平衡转化率升高,其原因为
的平衡转化率升高,其原因为
您最近一年使用:0次
名校
解题方法
10 . 对石油开采和炼制过程中产生的含硫废水(其中硫元素的主要化合价是﹣2价)进行处理,防止污染环境。
已知:i.﹣2价硫元素易被氧化为S或
ii.在25℃时,1体积水可溶解约2.6体积的 气体
气体
iii. 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
向pH≈10的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。
①pH≈10的含硫废水中含﹣2价硫元素的主要微粒是___________ 。
②用化学平衡移动原理解释pH降低的原因:___________ 。
③初始pH=10时,除硫效果好。初始pH<4,硫的沉淀率很低,原因是___________ 。
(2)氧化法处理含硫废水
向含硫废水中加入稀 调节溶液的pH为6。
调节溶液的pH为6。
①根据电离常数计算溶液中
___________ :1。
②再加入0.15mol/L 溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:
溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:___________ 。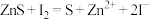 、
、
①处理后的废水中﹣2价硫元素的含量是___________ mg/L。
②加入 溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为
溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为 ,使测得的﹣2价硫元素含量
,使测得的﹣2价硫元素含量___________ (填“偏大”或“偏小”)。
已知:i.﹣2价硫元素易被氧化为S或

ii.在25℃时,1体积水可溶解约2.6体积的
 气体
气体iii.
 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
向pH≈10的含硫废水中加入适量
 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。①pH≈10的含硫废水中含﹣2价硫元素的主要微粒是
②用化学平衡移动原理解释pH降低的原因:
③初始pH=10时,除硫效果好。初始pH<4,硫的沉淀率很低,原因是
(2)氧化法处理含硫废水
向含硫废水中加入稀
 调节溶液的pH为6。
调节溶液的pH为6。①根据电离常数计算溶液中

②再加入0.15mol/L
 溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:
溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:

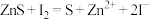 、
、
①处理后的废水中﹣2价硫元素的含量是
②加入
 溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为
溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为 ,使测得的﹣2价硫元素含量
,使测得的﹣2价硫元素含量
您最近一年使用:0次
2023-05-11更新
|
747次组卷
|
6卷引用:北京市西城区2023届高三二模化学试题
北京市西城区2023届高三二模化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题 北京市第一○一中学2023-2024学年高三上学期12月统练六化学试题 北京师范大学附属中学2023-2024学年高三上学期12月月考化学(2)试题(已下线)北京市第四中学2023-2024学年高三下学期开学摸底测验化学试题(已下线)FHgkyldyjhx09