解题方法
1 . 饮用水中含砷会导致砷中毒,金属冶炼过程产生的含砷有毒废物需处理与检测。冶炼废水中砷元素主要以亚砷酸 形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图: 与过量的
与过量的 存在反应:
存在反应: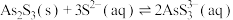 ;
;
②亚砷酸 盐的溶解性大于相应的砷酸
盐的溶解性大于相应的砷酸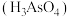 盐。
盐。
(1)①实验操作1和2是___________ 。
②“一级沉砷”先加入硫化钠主要发生的离子反应是:___________ 。
③一级沉砷后再加入硫酸亚铁的主要作用是:___________ 。
(2)“二级沉砷”先加入双氧水发生的反应有:___________ 。沉淀 的成分是
的成分是___________ 。
(3)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿 被氧化为
被氧化为 ,同时生成
,同时生成 ,导致砷脱离矿体进入地下水。
,导致砷脱离矿体进入地下水。 被
被 氧化的离子方程式是
氧化的离子方程式是___________ 。
(4)测定某 溶液(含少量
溶液(含少量 )中
)中 浓度的一种方法如下:
浓度的一种方法如下:
已知:用 标准溶液滴定弱酸溶液,一般要求弱酸的
标准溶液滴定弱酸溶液,一般要求弱酸的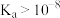 。
。
i.调 :取
:取 待测液,向其中滴入适量
待测液,向其中滴入适量 溶液调节
溶液调节 ,中和
,中和 。
。
ii.氧化:向上述溶液中加入适量碘水,将 氧化为
氧化为 。
。
iii.滴定:用 标准溶液滴定ⅱ中得到的
标准溶液滴定ⅱ中得到的 溶液至终点,消耗
溶液至终点,消耗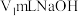 标准溶液。
标准溶液。___________ 。
②若无i,会导致测定的 浓度
浓度___________ (填“偏高”或“偏低”)。
③通过计算可知亚砷酸的浓度为___________ 。
 形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图: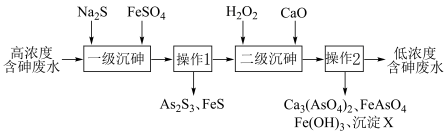
 与过量的
与过量的 存在反应:
存在反应: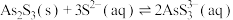 ;
;②亚砷酸
 盐的溶解性大于相应的砷酸
盐的溶解性大于相应的砷酸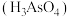 盐。
盐。(1)①实验操作1和2是
②“一级沉砷”先加入硫化钠主要发生的离子反应是:
③一级沉砷后再加入硫酸亚铁的主要作用是:
(2)“二级沉砷”先加入双氧水发生的反应有:
 的成分是
的成分是(3)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿
 被氧化为
被氧化为 ,同时生成
,同时生成 ,导致砷脱离矿体进入地下水。
,导致砷脱离矿体进入地下水。 被
被 氧化的离子方程式是
氧化的离子方程式是(4)测定某
 溶液(含少量
溶液(含少量 )中
)中 浓度的一种方法如下:
浓度的一种方法如下:已知:用
 标准溶液滴定弱酸溶液,一般要求弱酸的
标准溶液滴定弱酸溶液,一般要求弱酸的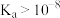 。
。i.调
 :取
:取 待测液,向其中滴入适量
待测液,向其中滴入适量 溶液调节
溶液调节 ,中和
,中和 。
。ii.氧化:向上述溶液中加入适量碘水,将
 氧化为
氧化为 。
。iii.滴定:用
 标准溶液滴定ⅱ中得到的
标准溶液滴定ⅱ中得到的 溶液至终点,消耗
溶液至终点,消耗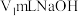 标准溶液。
标准溶液。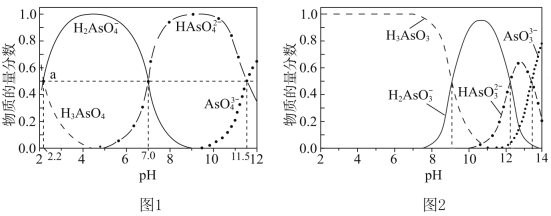
②若无i,会导致测定的
 浓度
浓度③通过计算可知亚砷酸的浓度为
您最近一年使用:0次
2 . 氯化磷酸三钠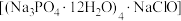 具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为
具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为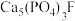 ,含杂质
,含杂质 、
、 等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
b.常温下 的
的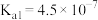 ,
,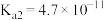 ;
; 。
。
c.常温下,磷酸中含磷微粒分布分数[如 的分布分数表示为
的分布分数表示为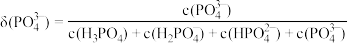 ]与pH的关系如下图所示:
]与pH的关系如下图所示:___________ 。
(2)常温下,“中和Ⅰ”应控制的pH约为___________ , 的
的
___________ 。
(3)“中和Ⅱ”不用 溶液,其原因是
溶液,其原因是___________ 。
(4)“合成”过程中两种溶液混合后需快速冷却,原因是___________ ;“系列操作”中包含“蒸发浓缩、冷却结晶、过滤、洗涤、干燥”,干燥时需控制温度不超过60℃的原因是___________ 。母液可以进入___________ (填操作单元名称)进行循环利用。
 具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为
具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为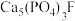 ,含杂质
,含杂质 、
、 等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题: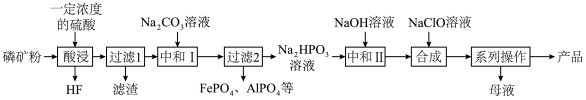
b.常温下
 的
的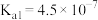 ,
,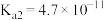 ;
; 。
。c.常温下,磷酸中含磷微粒分布分数[如
 的分布分数表示为
的分布分数表示为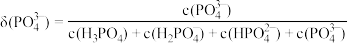 ]与pH的关系如下图所示:
]与pH的关系如下图所示: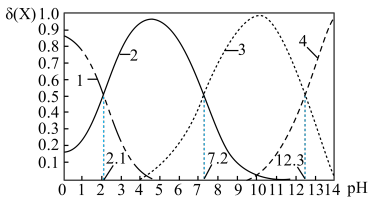
(2)常温下,“中和Ⅰ”应控制的pH约为
 的
的
(3)“中和Ⅱ”不用
 溶液,其原因是
溶液,其原因是(4)“合成”过程中两种溶液混合后需快速冷却,原因是
您最近一年使用:0次
名校
解题方法
3 . 二氧化铈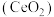 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)“氧化焙烧”中氧化的目的是___________ 。
(2)“酸浸”时提高浸取率的方法___________ (写出一种)。
(3)“萃取”时存在反应: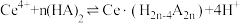 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为___________ (填标号);硫酸浓度过大时,萃取率降低的原因是___________ 。
(4)“反萃取”中,在稀硫酸和 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:___________ 。
(5)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于___________ 时, 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
(6)二氧化铈( )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物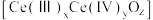 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为___________ ,当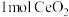 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为___________ 。
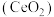 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 能与
能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)“氧化焙烧”中氧化的目的是
(2)“酸浸”时提高浸取率的方法
(3)“萃取”时存在反应:
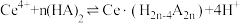 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
(4)“反萃取”中,在稀硫酸和
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(5)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)(6)二氧化铈(
 )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物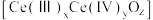 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为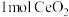 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为
您最近一年使用:0次
解题方法
4 . 一种以锌精矿(主要成分是ZnS,还含有铁、钴、铜等元素的氧化物)为原料制备纯锌并将其它金属元素回收利用的工艺流程如下: ),铁酸锌不溶于稀硫酸
),铁酸锌不溶于稀硫酸
②黄钠铁矾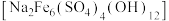 是一种浅黄色晶体,过滤及沉淀性能较好,但溶液酸性较强时不易生成
是一种浅黄色晶体,过滤及沉淀性能较好,但溶液酸性较强时不易生成
③ ;
;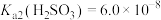 ;
;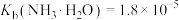
回答下列问题:
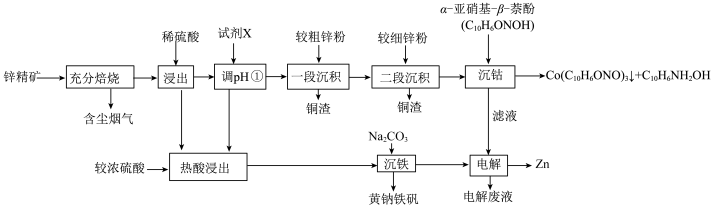
(1)常温下,“含尘烟气”中的 用氨水吸收至溶液的
用氨水吸收至溶液的 时,
时, 的平衡常数
的平衡常数
_______ 。
(2)“调pH①”试剂X可选用_______ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,一段时间后反应速率显著增大,请解释此现象产生的原因_______ 。
(4)“沉铁”步骤中,pH不宜过大或过小,原因是_______ ,“沉铁”时生成黄钠铁矾的离子方䅠式为_______ 。
(5)电解废液可返回到_______ 。操作进行循环利用。
(6)“沉钴”的离子方程式为_______ 。
 ),铁酸锌不溶于稀硫酸
),铁酸锌不溶于稀硫酸②黄钠铁矾
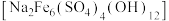 是一种浅黄色晶体,过滤及沉淀性能较好,但溶液酸性较强时不易生成
是一种浅黄色晶体,过滤及沉淀性能较好,但溶液酸性较强时不易生成③
 ;
; ;
;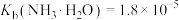
回答下列问题:
(1)常温下,“含尘烟气”中的
 用氨水吸收至溶液的
用氨水吸收至溶液的 时,
时, 的平衡常数
的平衡常数
(2)“调pH①”试剂X可选用
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,一段时间后反应速率显著增大,请解释此现象产生的原因
(4)“沉铁”步骤中,pH不宜过大或过小,原因是
(5)电解废液可返回到
(6)“沉钴”的离子方程式为
您最近一年使用:0次
5 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.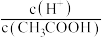 C.
C.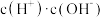 D.
D. E.
E. 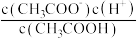
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
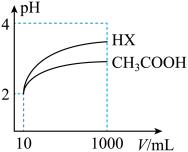
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
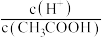 C.
C.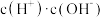 D.
D. E.
E. 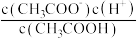
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
您最近一年使用:0次
名校
解题方法
6 .  不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体
不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体 和
和 进行重整,涉及主要反应如下:
进行重整,涉及主要反应如下:
反应I: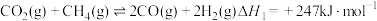
反应Ⅱ:
(1)若恒温、恒压的密闭容器中只发生反应I,下列能说明反应已达到化学平衡状态的是______。
(2)恒温刚性密闭容器中,按 投料,初始总压3MPa,达到平衡状态时测得
投料,初始总压3MPa,达到平衡状态时测得 和
和 转化率分别为60%、40%。计算该温度下反应I的压强平衡常数
转化率分别为60%、40%。计算该温度下反应I的压强平衡常数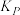 =
=______  (用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。
(用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。
(3)某研究小组为了评估甲烷干重整反应中不同催化剂的性能差异,在常压、催化剂作用下,按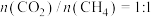 投料,不同温度下反应相同时间,测得
投料,不同温度下反应相同时间,测得 的转化率(柱形图)和产物
的转化率(柱形图)和产物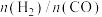 (
( )如图所示。请分析产物
)如图所示。请分析产物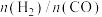 随温度变化的原因(不考虑催化剂失活)
随温度变化的原因(不考虑催化剂失活)______ 。 ;
;
(b) 。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在
。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在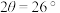 出现衍射峰,下列说法正确的是______。
出现衍射峰,下列说法正确的是______。
(5)该研究小组查阅资料发现还可利用电解还原 ,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
 溶液,在298K下加入醋酸钾固体将
溶液,在298K下加入醋酸钾固体将 调至
调至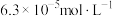 ,忽略溶液体积变化,所加醋酸钾固体的质量为
,忽略溶液体积变化,所加醋酸钾固体的质量为______ g。[已知:298K时, ]
]
 不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体
不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体 和
和 进行重整,涉及主要反应如下:
进行重整,涉及主要反应如下:反应I:
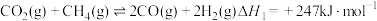
反应Ⅱ:

(1)若恒温、恒压的密闭容器中只发生反应I,下列能说明反应已达到化学平衡状态的是______。
| A.容器内气体密度不再发生变化 |
B. 和CO的物质的量之和不变 和CO的物质的量之和不变 |
C.化学反应速率 |
D.断裂4mol 键的同时生成2mol 键的同时生成2mol 键 键 |
(2)恒温刚性密闭容器中,按
 投料,初始总压3MPa,达到平衡状态时测得
投料,初始总压3MPa,达到平衡状态时测得 和
和 转化率分别为60%、40%。计算该温度下反应I的压强平衡常数
转化率分别为60%、40%。计算该温度下反应I的压强平衡常数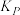 =
= (用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。
(用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。(3)某研究小组为了评估甲烷干重整反应中不同催化剂的性能差异,在常压、催化剂作用下,按
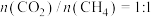 投料,不同温度下反应相同时间,测得
投料,不同温度下反应相同时间,测得 的转化率(柱形图)和产物
的转化率(柱形图)和产物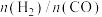 (
( )如图所示。请分析产物
)如图所示。请分析产物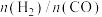 随温度变化的原因(不考虑催化剂失活)
随温度变化的原因(不考虑催化剂失活)
 ;
;(b)
 。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在
。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在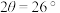 出现衍射峰,下列说法正确的是______。
出现衍射峰,下列说法正确的是______。
| A.碳附着在催化剂表面,使得活性位点与反应物之间的接触受阻,所以催化活性受到抑制 |
| B.一般甲烷干重整的反应温度都很高,因此副反应a很可能是实际过程中产生积碳的主要原因 |
| C.对比三种催化剂的X射线衍射结果可发现Ir型催化剂没有明显积碳,能在甲烷干重整过程中保持高稳定性 |
| D.该小组进一步评估新型金属复合催化剂(H型和M型)的积碳情况,将反应后的催化剂加热至恒重后,发现H型和M型催化剂的重量损失分别为16.7%和10.2%,这表明H型催化剂能在甲烷干重整过程中保持更高的稳定性 |
(5)该研究小组查阅资料发现还可利用电解还原
 ,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
 溶液,在298K下加入醋酸钾固体将
溶液,在298K下加入醋酸钾固体将 调至
调至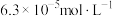 ,忽略溶液体积变化,所加醋酸钾固体的质量为
,忽略溶液体积变化,所加醋酸钾固体的质量为 ]
]
您最近一年使用:0次
名校
7 . 催化剂形貌的优化会影响生产效率。 可做烟气脱硝工艺的固相催化剂。
可做烟气脱硝工艺的固相催化剂。
已知:
ⅰ.常温下,AgOH极不稳定,易分解为难溶于水的 固体;
固体; ;
; 。
。
ⅱ.一般情况,析晶速率越快,晶粒尺寸越小。
(1)基态P原子的核外电子有____ 个空间运动状态,Ag、P、O元素的电负性由大到小的顺序为_______ 。
(2)某研究组调控反应条件控制 晶体形貌。
晶体形貌。
①常温下,向银氨溶液逐滴加入 溶液制得
溶液制得 晶体,完善该反应的离子方程式
晶体,完善该反应的离子方程式_______ 。

②在不同pH条件下,向 溶液中加入
溶液中加入 溶液制得磷酸银收率如图所示。样品A的晶粒较小,请从平衡移动与速率的角度解释原因
溶液制得磷酸银收率如图所示。样品A的晶粒较小,请从平衡移动与速率的角度解释原因_____________ 。___________
A.样品A中 杂质含量最高
杂质含量最高
B.可加入盐酸调控体系的pH制得不同样品
C.向 溶液中加入少量
溶液中加入少量 溶液时,溶液中
溶液时,溶液中 减小
减小
D.向 溶液中加入
溶液中加入 溶液得到晶粒尺寸与上述样品相同
溶液得到晶粒尺寸与上述样品相同
(3)研究组发现: 溶液与0.2
溶液与0.2
 溶液等体积混合也能制得
溶液等体积混合也能制得 。
。
①刚开始生成 沉淀时,溶液中的
沉淀时,溶液中的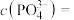
___________ 。
②常温下溶液中含磷物种的分布系数 ,
, 或
或 与pH的关系如图所示,则磷酸的一级电离平衡常数
与pH的关系如图所示,则磷酸的一级电离平衡常数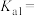
_________ 。 由
由 第一步电离决定,可表示为
第一步电离决定,可表示为 ,当生成
,当生成 沉淀时,溶液中
沉淀时,溶液中 至少为
至少为___________  (写出计算过程)。
(写出计算过程)。
 可做烟气脱硝工艺的固相催化剂。
可做烟气脱硝工艺的固相催化剂。已知:
ⅰ.常温下,AgOH极不稳定,易分解为难溶于水的
 固体;
固体; ;
; 。
。ⅱ.一般情况,析晶速率越快,晶粒尺寸越小。
(1)基态P原子的核外电子有
(2)某研究组调控反应条件控制
 晶体形貌。
晶体形貌。①常温下,向银氨溶液逐滴加入
 溶液制得
溶液制得 晶体,完善该反应的离子方程式
晶体,完善该反应的离子方程式
②在不同pH条件下,向
 溶液中加入
溶液中加入 溶液制得磷酸银收率如图所示。样品A的晶粒较小,请从平衡移动与速率的角度解释原因
溶液制得磷酸银收率如图所示。样品A的晶粒较小,请从平衡移动与速率的角度解释原因
A.样品A中
 杂质含量最高
杂质含量最高B.可加入盐酸调控体系的pH制得不同样品
C.向
 溶液中加入少量
溶液中加入少量 溶液时,溶液中
溶液时,溶液中 减小
减小D.向
 溶液中加入
溶液中加入 溶液得到晶粒尺寸与上述样品相同
溶液得到晶粒尺寸与上述样品相同(3)研究组发现:
 溶液与0.2
溶液与0.2
 溶液等体积混合也能制得
溶液等体积混合也能制得 。
。①刚开始生成
 沉淀时,溶液中的
沉淀时,溶液中的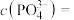
②常温下溶液中含磷物种的分布系数
 ,
, 或
或 与pH的关系如图所示,则磷酸的一级电离平衡常数
与pH的关系如图所示,则磷酸的一级电离平衡常数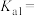

 由
由 第一步电离决定,可表示为
第一步电离决定,可表示为 ,当生成
,当生成 沉淀时,溶液中
沉淀时,溶液中 至少为
至少为 (写出计算过程)。
(写出计算过程)。
您最近一年使用:0次
2024-05-19更新
|
476次组卷
|
2卷引用:广东省大湾区普通高中2024届高三下学期毕业年级联合模拟考试(二)化学试卷
8 . 实验室模拟某含有机酸 工业废水的处理过程。
工业废水的处理过程。
 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:
(1) 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:


①基态 的价电子排布式为
的价电子排布式为___________ 。
②下列有关上述络合反应的说法中,正确的有___________ (填标号)。
A.反应达平衡时,溶液的颜色不再变化
B.增大 浓度,逆反应速率减小
浓度,逆反应速率减小
C. 过低不利于
过低不利于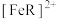 的生成
的生成
D.升高温度,该平衡正向移动
(2)紫外光催化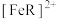 降解:
降解:
若有机酸为 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为:___________ 。
 ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:
(i)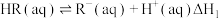
(ii)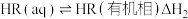
(iii)
(3)根据盖斯定律,反应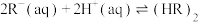 (有机相)的
(有机相)的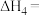
___________ 。
(4)水相的 以及体系温度
以及体系温度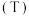 对
对 的平衡分配比
的平衡分配比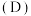 有影响。
有影响。
已知: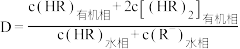 。
。
①常温下,配制体积相同、 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析 随
随 升高而降低的原因
升高而降低的原因___________ 。 溶液
溶液 时,
时,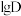 随
随 的变化曲线如图所示。
的变化曲线如图所示。 萃取宜在
萃取宜在___________ 温度下进行(填“较高”或“较低”)。
 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数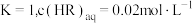 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中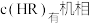
___________ 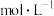 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数
___________ (写出计算过程)。
 工业废水的处理过程。
工业废水的处理过程。 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:(1)
 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:

①基态
 的价电子排布式为
的价电子排布式为②下列有关上述络合反应的说法中,正确的有
A.反应达平衡时,溶液的颜色不再变化
B.增大
 浓度,逆反应速率减小
浓度,逆反应速率减小C.
 过低不利于
过低不利于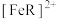 的生成
的生成 D.升高温度,该平衡正向移动
(2)紫外光催化
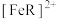 降解:
降解:若有机酸为
 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为: ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:(i)
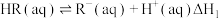
(ii)
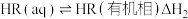
(iii)

(3)根据盖斯定律,反应
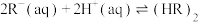 (有机相)的
(有机相)的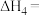
(4)水相的
 以及体系温度
以及体系温度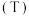 对
对 的平衡分配比
的平衡分配比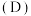 有影响。
有影响。已知:
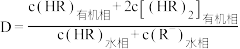 。
。①常温下,配制体积相同、
 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析 随
随 升高而降低的原因
升高而降低的原因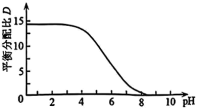
 溶液
溶液 时,
时,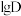 随
随 的变化曲线如图所示。
的变化曲线如图所示。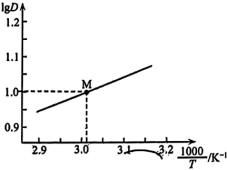
 萃取宜在
萃取宜在 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数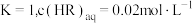 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中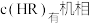
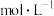 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数
您最近一年使用:0次
9 . 硼是第ⅢA族中唯一的非金属元素,可以形成众多的化合物。回答下列问题:
(1)硼烷泛指一切硼和氢组成的化合物。乙硼烷( )是最简单的硼烷,可以在
)是最简单的硼烷,可以在_______ (填“乙酸”或“乙醚”或“水”)介质中使用 还原
还原 获得,
获得, 的电子式为
的电子式为_______ ,制备乙硼烷的化学方程式为_______ 。 )的溶解度
)的溶解度
(2)操作1是蒸发浓缩、冷却结晶、过滤、_______ ,干燥;整个流程中可循环利用的物质是_______ 。
(3)硼酸( )是一元弱酸,在溶液中存在平衡:
)是一元弱酸,在溶液中存在平衡: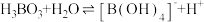 (常温下:
(常温下: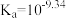 ),
), 与NaOH溶液反应可制备硼砂。常温下,在
与NaOH溶液反应可制备硼砂。常温下,在 硼砂溶液中,
硼砂溶液中,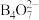 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该溶液pH=
,该溶液pH=_______ 。常温常压下,硼酸( )晶体结构为层状,其二维平面结构如图所示:
)晶体结构为层状,其二维平面结构如图所示:_______ 。
(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化合物,其原因为_______ 。
(1)硼烷泛指一切硼和氢组成的化合物。乙硼烷(
 )是最简单的硼烷,可以在
)是最简单的硼烷,可以在 还原
还原 获得,
获得, 的电子式为
的电子式为
 )的溶解度
)的溶解度| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 80 |
| 溶解度/g | 2.77 | 3.65 | 4.87 | 6.77 | 8.90 | 23.54 |
(2)操作1是蒸发浓缩、冷却结晶、过滤、
(3)硼酸(
 )是一元弱酸,在溶液中存在平衡:
)是一元弱酸,在溶液中存在平衡: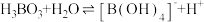 (常温下:
(常温下: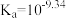 ),
), 与NaOH溶液反应可制备硼砂。常温下,在
与NaOH溶液反应可制备硼砂。常温下,在 硼砂溶液中,
硼砂溶液中,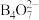 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该溶液pH=
,该溶液pH= )晶体结构为层状,其二维平面结构如图所示:
)晶体结构为层状,其二维平面结构如图所示: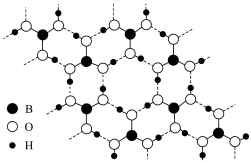
H3BO3的层状结构
从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
| 化学键 |  |  |  |
键能( ) ) | 389 | 561 | 293 |
您最近一年使用:0次
名校
解题方法
10 . 氧化钪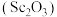 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含 、
、 等离子)为原料制备氧化钪
等离子)为原料制备氧化钪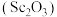 的一种流程如下图。
的一种流程如下图。
(1)基态钪原子的价层电子排布式为___________ 。
(2)“萃取”时,钛白工业废酸中加入 可降低钛的萃取率,可能是生成了难萃取的
可降低钛的萃取率,可能是生成了难萃取的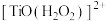 ,其中
,其中 的作用是
的作用是___________ (填标号)。
A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用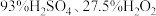 和
和 三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将A试剂沿烧杯内壁缓慢注入B试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入C试剂中,并不断搅拌,则A、C分别对应上述试剂中的
三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将A试剂沿烧杯内壁缓慢注入B试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入C试剂中,并不断搅拌,则A、C分别对应上述试剂中的___________ 、___________ 。
(4)萃取剂萃取 的原理为
的原理为 (
(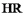 代表萃取剂)。在“反萃取”中,加入
代表萃取剂)。在“反萃取”中,加入 溶液后生成
溶液后生成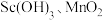 等物质,其中生成含
等物质,其中生成含 化合物的化学方程式为
化合物的化学方程式为___________ 。 时,经“反萃取”后所得滤液的
时,经“反萃取”后所得滤液的 ,则残留的
,则残留的 浓度为
浓度为___________  (已知:
(已知: 时,
时, 。
。
(5)“沉钪”时用到草酸。已知草酸的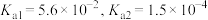 ,则在
,则在 时,
时, 的草酸溶液中
的草酸溶液中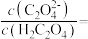
___________ 。
(6)在空气中焙烧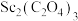 的化学方程式为
的化学方程式为___________ 。
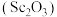 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含 、
、 等离子)为原料制备氧化钪
等离子)为原料制备氧化钪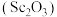 的一种流程如下图。
的一种流程如下图。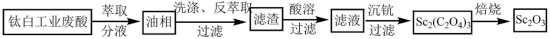
(1)基态钪原子的价层电子排布式为
(2)“萃取”时,钛白工业废酸中加入
 可降低钛的萃取率,可能是生成了难萃取的
可降低钛的萃取率,可能是生成了难萃取的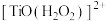 ,其中
,其中 的作用是
的作用是A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用
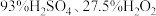 和
和 三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将A试剂沿烧杯内壁缓慢注入B试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入C试剂中,并不断搅拌,则A、C分别对应上述试剂中的
三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将A试剂沿烧杯内壁缓慢注入B试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入C试剂中,并不断搅拌,则A、C分别对应上述试剂中的(4)萃取剂萃取
 的原理为
的原理为 (
(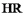 代表萃取剂)。在“反萃取”中,加入
代表萃取剂)。在“反萃取”中,加入 溶液后生成
溶液后生成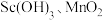 等物质,其中生成含
等物质,其中生成含 化合物的化学方程式为
化合物的化学方程式为 时,经“反萃取”后所得滤液的
时,经“反萃取”后所得滤液的 ,则残留的
,则残留的 浓度为
浓度为 (已知:
(已知: 时,
时, 。
。(5)“沉钪”时用到草酸。已知草酸的
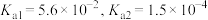 ,则在
,则在 时,
时, 的草酸溶液中
的草酸溶液中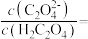
(6)在空气中焙烧
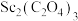 的化学方程式为
的化学方程式为
您最近一年使用:0次



