1 . 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。 时,部分物质的相关平衡常数如表所示,按要求回答下列问题:
时,部分物质的相关平衡常数如表所示,按要求回答下列问题:
(1)相同温度下,相等物质的量浓度溶液中,判断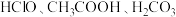 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为_______ 。
(2)将少量 气体通入
气体通入 溶液中,发生的离子方程式为
溶液中,发生的离子方程式为_______ 。
(3)相同温度下,判断 溶液显
溶液显_______ (填“酸性”、“中性”、“碱性”),物质的量浓度相等的下列溶液① ②
② ③
③ ④
④ ,溶液中的
,溶液中的 浓度由大到小的顺序为
浓度由大到小的顺序为_______ (用序号表示)。
(4)下列事实可以证明 是弱碱的有
是弱碱的有_______ (填序号)。
①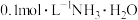 溶液能使酚酞溶液变红
溶液能使酚酞溶液变红
②常温下,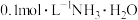 溶液的
溶液的
③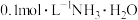 溶液的导电性比
溶液的导电性比 溶液弱
溶液弱
④等体积的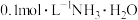 溶液与
溶液与 溶液恰好完全反应
溶液恰好完全反应
⑤ 的
的 溶液稀释至100倍,
溶液稀释至100倍, 约为10
约为10
(5) 的
的 溶液与
溶液与 的
的 溶液等体积混合后,溶液中四种离子物质的量浓度由大到小的顺序为
溶液等体积混合后,溶液中四种离子物质的量浓度由大到小的顺序为_______ 。
(6)已知不同 条件下,水溶液中碳元素的存在形态如图所示。
条件下,水溶液中碳元素的存在形态如图所示。
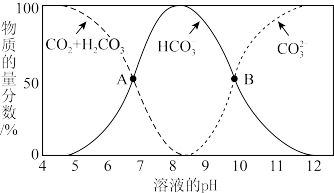
下列说法不正确的是_______ 。
a. 时,溶液中含碳元素的微粒主要是
时,溶液中含碳元素的微粒主要是
b.A点,溶液中 和
和 浓度相同
浓度相同
c.当 时,
时,
(7)水垢中的 可用
可用 溶液处理。当两种沉淀共存于溶液中,此时
溶液处理。当两种沉淀共存于溶液中,此时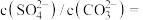
_______ 。
 时,部分物质的相关平衡常数如表所示,按要求回答下列问题:
时,部分物质的相关平衡常数如表所示,按要求回答下列问题:| 化学式 | 相关平衡常数 | 化学式 | 相关平衡常数 |
 | 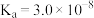 |  | 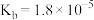 |
 |  |  | 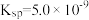 |
 | 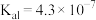  |  | 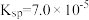 |
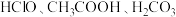 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为(2)将少量
 气体通入
气体通入 溶液中,发生的离子方程式为
溶液中,发生的离子方程式为(3)相同温度下,判断
 溶液显
溶液显 ②
② ③
③ ④
④ ,溶液中的
,溶液中的 浓度由大到小的顺序为
浓度由大到小的顺序为(4)下列事实可以证明
 是弱碱的有
是弱碱的有①
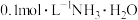 溶液能使酚酞溶液变红
溶液能使酚酞溶液变红②常温下,
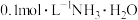 溶液的
溶液的
③
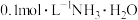 溶液的导电性比
溶液的导电性比 溶液弱
溶液弱④等体积的
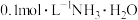 溶液与
溶液与 溶液恰好完全反应
溶液恰好完全反应⑤
 的
的 溶液稀释至100倍,
溶液稀释至100倍, 约为10
约为10(5)
 的
的 溶液与
溶液与 的
的 溶液等体积混合后,溶液中四种离子物质的量浓度由大到小的顺序为
溶液等体积混合后,溶液中四种离子物质的量浓度由大到小的顺序为(6)已知不同
 条件下,水溶液中碳元素的存在形态如图所示。
条件下,水溶液中碳元素的存在形态如图所示。
下列说法不正确的是
a.
 时,溶液中含碳元素的微粒主要是
时,溶液中含碳元素的微粒主要是
b.A点,溶液中
 和
和 浓度相同
浓度相同c.当
 时,
时,
(7)水垢中的
 可用
可用 溶液处理。当两种沉淀共存于溶液中,此时
溶液处理。当两种沉淀共存于溶液中,此时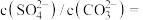
您最近一年使用:0次
名校
2 . (I)常温下,有四种溶液:①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液 ④0.1 mol·L-1 NaHCO3溶液
(1)溶液②呈___________ (填“酸”“碱”或“中”)性。其原因___________ (用离子方程式说明)。
(2)下列有关①和②两种溶液的说法正确的是___________ (填字母)。
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(3)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3中HSO 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填字母)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(II)已知25 ℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。使20 mL 0.10 mol·L-1的CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与20 mL 0.10 mol·L-1的NaHCO3溶液反应。
(4)反应结束后,所得溶液中c(SCN-)___________ (填“>”“=”或“<”)c(CH3COO-)。
(5)现有2.0×10-3 mol·L-1的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),测得25 ℃时平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示:
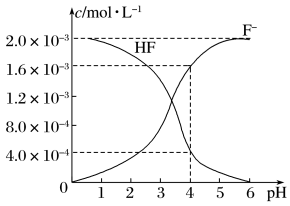
25 ℃时,HF的电离平衡常数Ka(HF)=___________ 。
(6)已知:25 ℃时,HCOOH的电离平衡常数K=1.77×10-4,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是___________(填字母)。
(1)溶液②呈
(2)下列有关①和②两种溶液的说法正确的是
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(3)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3中HSO
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(II)已知25 ℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。使20 mL 0.10 mol·L-1的CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与20 mL 0.10 mol·L-1的NaHCO3溶液反应。
(4)反应结束后,所得溶液中c(SCN-)
(5)现有2.0×10-3 mol·L-1的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),测得25 ℃时平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示:

25 ℃时,HF的电离平衡常数Ka(HF)=
(6)已知:25 ℃时,HCOOH的电离平衡常数K=1.77×10-4,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是___________(填字母)。
| A.向Na2CO3溶液中加入甲酸溶液无明显现象产生 |
| B.25 ℃时,向甲酸溶液中加入NaOH溶液,甲酸的电离程度和K均增大 |
C.向0.1 mol·L-1甲酸溶液中加入蒸馏水, 增大 增大 |
D.向碳酸中加入NaHCO3固体,溶液的pH、溶液中c(HCO )均增大 )均增大 |
您最近一年使用:0次
名校
3 . 氨气和氯气是重要的工业原料,某兴趣小组设计了相关实验探究它们的某些性质。实验一:用氨气认识喷泉实验的原理,并测定电离平衡常数K(NH3•H2O)。


(1)检查图1的装置Ⅰ的气密性的方法是_____________________________________________ 。
(2)喷泉实验结束后,发现三颈烧瓶未充满水(假如装置的气密性良好),原因是_______________ 。用___________ (填仪器名称)量取25.00mL喷泉实验后的氨水至锥形瓶中,用0.0500mol/L盐酸滴定测定氨水的浓度,滴定曲线如图2所示。下列关于该滴定实验的说法中正确的是__________ (选填字母)。
A.当pH=7.0时,氨水与盐酸恰好中和B.选择酚酞作为指示剂,测定结果偏低
C.酸式滴定管未用盐酸润洗会导致测定结果偏低D.当 pH=11.0 时,K(NH3•H2O)约为2.2×10-5
实验二:拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。

(3)A中所发生反应的化学方程式为__________________________________________________ 。
(4)上图中的装置连接顺序为A→_________ →_________ →_________ →_________ →_________ (用大写字母表示)。若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点是________________________ 。
(5)写出F装置中的反应的一种工业用途_________________________________________ 。
(6)反应完成后,F装置中底部有固体物质生成。请利用该固体物质设计一个实验方案证明NH3•H2O为弱碱(其余实验用品自选)_______________________________________________________________ 。


(1)检查图1的装置Ⅰ的气密性的方法是
(2)喷泉实验结束后,发现三颈烧瓶未充满水(假如装置的气密性良好),原因是
A.当pH=7.0时,氨水与盐酸恰好中和B.选择酚酞作为指示剂,测定结果偏低
C.酸式滴定管未用盐酸润洗会导致测定结果偏低D.当 pH=11.0 时,K(NH3•H2O)约为2.2×10-5
实验二:拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。

(3)A中所发生反应的化学方程式为
(4)上图中的装置连接顺序为A→
(5)写出F装置中的反应的一种工业用途
(6)反应完成后,F装置中底部有固体物质生成。请利用该固体物质设计一个实验方案证明NH3•H2O为弱碱(其余实验用品自选)
您最近一年使用:0次
解题方法
4 . 过氧化氢是淡蓝色的黏稠液体,可。与水以任意比例混溶,是一种强氧化剂。其一般以30%~60%的水溶液形式存放,水溶液俗称双氧水,适用于医用伤口消毒,环境消毒和食品消毒等。回答下列问题:
(1)实验室中利用反应2H2O2 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是___________ (填字母,下同),收集O2可选用的装置是___________ (填字母)。___________ mL(保留三位有效数字)。
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:___________
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
⑤数据分析、交流讨论。
实验结果:X2<X1<X3且X1=___________ ,测得pH数据中能证明上述猜想的是___________ (用X1、X2、X3的大小关系表示);pH出现X1<X3的原因是___________ 。
⑥优化实验。在20℃下进行下列实验:
若实验中测得△T1___________ △T2(填“>”或“<”),则说明H2O2电离过程吸热。
(1)实验室中利用反应2H2O2
 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是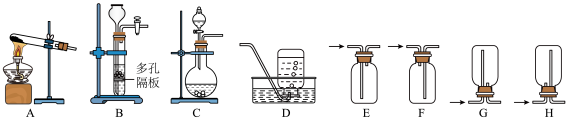
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
| 试祥 | 温度/℃ | pH | |
| 1 | 10mL1.5mol/L的双氧水 | 20 | X1 |
| 2 | 10mL1.5mol/L的双氧水 | 30 | X2 |
| 3 | 10mL1.5mol/L的双氧水 | 50 | X3 |
实验结果:X2<X1<X3且X1=
⑥优化实验。在20℃下进行下列实验:
| 试样 | 反应前后温度变化/℃ | |
| 4 | 10mL1.5mol/L的双氧水、10mL1.5mol/L的NaOH溶液 | △T1 |
| 5 | 10mL1.5mol/L的H2SO4溶液10mL1.5mol/L的NaOH溶液 | △T2 |
您最近一年使用:0次
名校
5 . 已知常见的酸的电离平衡常数如下(均为常温下的数据):
回答下列问题。
(1)下列事实能证明草酸是弱电解质的是______(填标号)。
(2)同浓度的 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是______ 。
(3)常温下 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
(4)向 溶液中加入少量
溶液中加入少量 溶液,反应
溶液,反应 离子方程式为
离子方程式为____________ 。
(5)常温下,向 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,溶液中
,溶液中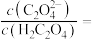
______ 。
(6) 的
的 溶液和
溶液和 的
的 溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:____________ 。
| 化学式 |  | HClO |  |  |
| 电离平衡常数 |  |  | 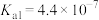  | 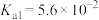 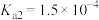 |
(1)下列事实能证明草酸是弱电解质的是______(填标号)。
A.草酸能使酸性 溶液褪色 溶液褪色 |
B.常温下, 的 的 溶液的 溶液的 |
C.相同条件下,浓度均为 的 的 溶液的导电能力比硫酸的导电能力弱 溶液的导电能力比硫酸的导电能力弱 |
D. 溶液中存在 溶液中存在 分子,呈酸性 分子,呈酸性 |
 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是(3)常温下
 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。A. | B. | C. | D. |
 溶液中加入少量
溶液中加入少量 溶液,反应
溶液,反应 离子方程式为
离子方程式为(5)常温下,向
 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,溶液中
,溶液中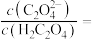
(6)
 的
的 溶液和
溶液和 的
的 溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
您最近一年使用:0次
6 . 以高铅硫化锌原矿[主要含有ZnS,含有少量PbS、ZnCO3、SiO2、FeS、In2O3(氧化铟)等]为原料制备单质Zn的工艺流程如下:

已知:①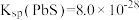 ,
,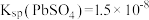 ,
,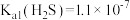 ,
,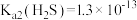 。
。
②电解液浓度过大会导致溶液粘度变大,离子迁移速率低,电解效率低。
回答下列问题:
(1)“沸腾焙烧”的目的是___________ ;其中杂质FeS充分焙烧产生大量废气,其主要成分的空间结构为___________ 。
(2)“滤渣I”的主要成分为___________ 和PbSO4。若撤去“焙烧”,直接“酸浸”,调节溶液中c(H+)=4.0 mol/L,若要将PbS中的Pb2+沉淀完全,试计算溶液中c(H2S)的范围___________ (保留小数点后两位)。[已知H2S饱和溶液中,c(H2S)=0.1 mol/L]。
(3)“除铁”时Fe2+转化为FeOOH的离子方程式为___________ 。
(4)“电解”硫酸锌溶液制备Zn的化学方程式为___________ ,工业所需电解液浓度为40-60 g/L的理由是___________ ,可用___________ 光谱证明阴极析出的固体为Zn。

已知:①
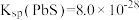 ,
,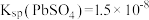 ,
,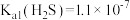 ,
,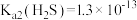 。
。②电解液浓度过大会导致溶液粘度变大,离子迁移速率低,电解效率低。
回答下列问题:
(1)“沸腾焙烧”的目的是
(2)“滤渣I”的主要成分为
(3)“除铁”时Fe2+转化为FeOOH的离子方程式为
(4)“电解”硫酸锌溶液制备Zn的化学方程式为
您最近一年使用:0次
解题方法
7 . 乙二酸俗称草酸(H2C2O4),是一种二元弱酸,易溶于水,具有还原性。25℃时,H2C2O4的电离平衡常数Ka1=5.6×10-2,Ka2=1.5×10-4。
Ⅰ.学习小组甲用酸性KMnO4标准溶液滴定未知浓度的草酸溶液。
(1)H2C2O4中C的化合价为___________ ;
(2)0.1mol/L NaHC2O4溶液中各离子浓度由大到小的顺序为___________ ;
(3)某学生的滴定方式(夹持部分略去)如图1所示,合理的是___________ (填“a”或“b”),由图2可知消耗KMnO4溶液体积为___________ mL。

Ⅱ.学习小组乙查阅文献获得以下信息:
①三水三草酸合铁酸钾[K3Fe(C2O4)3·3H2O]为翠绿色晶体,光照易分解,[Fe(C2O4)3]3-是一种稳定的配离子,能类似于Fe(SCN)3中的[Fe(SCN)]2+在溶液中稳定存在。[Fe(C2O4)3]3-和[Fe(SCN)]2+存在如下平衡:
ⅰ.[Fe(SCN)]2+(红色) Fe3++SCN-
Fe3++SCN-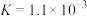
ⅱ.[Fe(C2O4)3]3- Fe3++3
Fe3++3
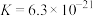
②相同条件下,草酸根( )的还原性强于
)的还原性强于
③FeC2O4·2H2O为黄色固体,微溶于水,可溶于强酸
【实验】探究Fe3+和草酸根在溶液中的反应。
(4)取实验中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,原因是___________ (结合ⅰ、ⅱ平衡,用必要的化学用语和数据解释原因),继续加入硫酸,溶液变红,说明加入硫酸,H+与C2O 结合使ⅱ平衡
结合使ⅱ平衡___________ 移动(填“正向”或“逆向”)。经检验发现上述实验中Fe3+和C2O 未发生氧化还原反应。
未发生氧化还原反应。
(5)设计一个实验证明草酸属于二元弱酸:___________ 。
Ⅰ.学习小组甲用酸性KMnO4标准溶液滴定未知浓度的草酸溶液。
(1)H2C2O4中C的化合价为
(2)0.1mol/L NaHC2O4溶液中各离子浓度由大到小的顺序为
(3)某学生的滴定方式(夹持部分略去)如图1所示,合理的是

Ⅱ.学习小组乙查阅文献获得以下信息:
①三水三草酸合铁酸钾[K3Fe(C2O4)3·3H2O]为翠绿色晶体,光照易分解,[Fe(C2O4)3]3-是一种稳定的配离子,能类似于Fe(SCN)3中的[Fe(SCN)]2+在溶液中稳定存在。[Fe(C2O4)3]3-和[Fe(SCN)]2+存在如下平衡:
ⅰ.[Fe(SCN)]2+(红色)
 Fe3++SCN-
Fe3++SCN-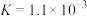
ⅱ.[Fe(C2O4)3]3-
 Fe3++3
Fe3++3
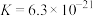
②相同条件下,草酸根(
 )的还原性强于
)的还原性强于
③FeC2O4·2H2O为黄色固体,微溶于水,可溶于强酸
【实验】探究Fe3+和草酸根在溶液中的反应。
| 操作 | 现象 |
在避光处,向10mL 0.5  溶液中缓慢加入0.5 溶液中缓慢加入0.5  溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到翠绿色溶液和翠绿色晶体 |
 结合使ⅱ平衡
结合使ⅱ平衡 未发生氧化还原反应。
未发生氧化还原反应。(5)设计一个实验证明草酸属于二元弱酸:
您最近一年使用:0次
8 . 常温下4种酸的电离平衡常数如下:
(1)次氯酸的电离方程式为___________ 。
(2)物质的量浓度相同的 HF 、CH3COOH、H2CO3、HClO中,酸性由小到大的顺序为___________ 。
(3)保持温度不变,向 的醋酸溶液中加入或通入下列物质,
的醋酸溶液中加入或通入下列物质, 的电离度减小、溶液中的c(H+)增大的是___________(填标号)。
的电离度减小、溶液中的c(H+)增大的是___________(填标号)。
(4)下列实验事实不能证明醋酸是弱酸的是________
(5)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是__________
(6)常温下,物质的量浓度为 的醋酸溶液中,达到电离平衡时c(H+)约为
的醋酸溶液中,达到电离平衡时c(H+)约为___________ ,此时醋酸的电离度约为___________ (已知 )。
)。
| 化学式 | HF |  |  |  |
| 电离平衡常数 | 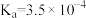 |  | 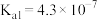  | 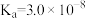 |
(2)物质的量浓度相同的 HF 、CH3COOH、H2CO3、HClO中,酸性由小到大的顺序为
(3)保持温度不变,向
 的醋酸溶液中加入或通入下列物质,
的醋酸溶液中加入或通入下列物质, 的电离度减小、溶液中的c(H+)增大的是___________(填标号)。
的电离度减小、溶液中的c(H+)增大的是___________(填标号)。| A.醋酸钠固体 | B.冰醋酸 | C.水 | D.氯化氢气体 |
| A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等 |
| B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4 |
| C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D.在相同条件下,醋酸溶液的导电性比盐酸的弱 |
A. | B. |
C. | D. |
 的醋酸溶液中,达到电离平衡时c(H+)约为
的醋酸溶液中,达到电离平衡时c(H+)约为 )。
)。
您最近一年使用:0次
9 . Ⅰ.甲酸(HCOOH)又名蚊酸,是一种常见的弱酸,常温下甲酸的电离平衡常数 (已知
(已知 )。
)。
(1)设计实验证明甲酸为弱酸,下列实验设计合理的是___________ (填字母)。
A.将甲酸溶液滴入 溶液中,观察是否有气泡生成
溶液中,观察是否有气泡生成
B.向体积相同、pH相同的盐酸和甲酸溶液中加入足量Zn,比较溶解Zn的质量
C.取一定浓度的甲酸钠溶液,测其pH
(2)常温下,将 的甲酸钠(HCOONa)溶液和
的甲酸钠(HCOONa)溶液和 的甲酸溶液等体积混合配成一种缓冲溶液。
的甲酸溶液等体积混合配成一种缓冲溶液。
①常温下, 的水解平衡常数
的水解平衡常数
___________ 。
②该混合溶液的pH约为___________ 。
③该混合溶液中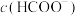
___________ (填“>”“=”或“<”) 。
。
Ⅱ.在一定条件下, 可还原氮氧化物,消除氮氧化物污染。工业上,常用
可还原氮氧化物,消除氮氧化物污染。工业上,常用 和
和 在催化剂作用下合成
在催化剂作用下合成 。在催化剂作用下,
。在催化剂作用下,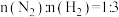 ,发生反应,平衡混合气中
,发生反应,平衡混合气中 的物质的量分数随温度和压强的变化关系如图所示。
的物质的量分数随温度和压强的变化关系如图所示。

(3)该反应的平衡常数Ka___________ (填“<”“=”或“>”)Kb。
(4)500℃、压强为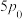 时,
时, 的转化率为
的转化率为___________ %(保留三位有效数字)。
 (已知
(已知 )。
)。(1)设计实验证明甲酸为弱酸,下列实验设计合理的是
A.将甲酸溶液滴入
 溶液中,观察是否有气泡生成
溶液中,观察是否有气泡生成B.向体积相同、pH相同的盐酸和甲酸溶液中加入足量Zn,比较溶解Zn的质量
C.取一定浓度的甲酸钠溶液,测其pH
(2)常温下,将
 的甲酸钠(HCOONa)溶液和
的甲酸钠(HCOONa)溶液和 的甲酸溶液等体积混合配成一种缓冲溶液。
的甲酸溶液等体积混合配成一种缓冲溶液。①常温下,
 的水解平衡常数
的水解平衡常数
②该混合溶液的pH约为
③该混合溶液中
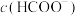
 。
。Ⅱ.在一定条件下,
 可还原氮氧化物,消除氮氧化物污染。工业上,常用
可还原氮氧化物,消除氮氧化物污染。工业上,常用 和
和 在催化剂作用下合成
在催化剂作用下合成 。在催化剂作用下,
。在催化剂作用下,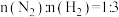 ,发生反应,平衡混合气中
,发生反应,平衡混合气中 的物质的量分数随温度和压强的变化关系如图所示。
的物质的量分数随温度和压强的变化关系如图所示。
(3)该反应的平衡常数Ka
(4)500℃、压强为
 时,
时, 的转化率为
的转化率为
您最近一年使用:0次
名校
10 . “84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法并测定相关反应的平衡常数。
资料:i.HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11
ii.碘的化合物主要以I-和 的形式存在,
的形式存在, +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-
 (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。
I制备消毒液(夹持装置略)
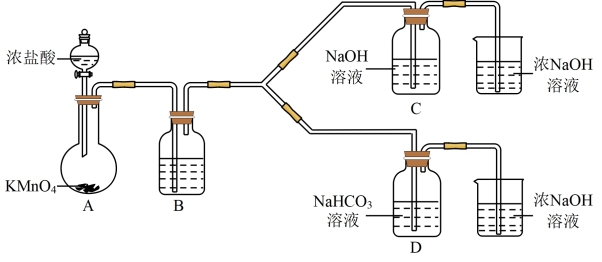
(1)制备NaClO的离子反应方程式___________ 。
(2)结合资料i,写出D中反应的化学方程式___________ 。
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(3)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为 。
。
设计实验a证实了假设1成立。NaClO氧化I2生成 的离子方程式是
的离子方程式是___________ 。
假设2:生成的I2在碱性溶液中不能存在。
设计实验b证实了假设2成立,实验b的操作及现象是___________ 。
(4)某小组检验烧杯3所得溶液中含 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由___________ 。
(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据___________ 。
资料:i.HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11
ii.碘的化合物主要以I-和
 的形式存在,
的形式存在, +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。iii.碘单质能与I-反应:I2+I-

 (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。I制备消毒液(夹持装置略)

(1)制备NaClO的离子反应方程式
(2)结合资料i,写出D中反应的化学方程式
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9gKI固体 | |溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9gKI固体,再加入1mol/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
假设1:过量的NaClO将反应生成的I2氧化为
 。
。设计实验a证实了假设1成立。NaClO氧化I2生成
 的离子方程式是
的离子方程式是假设2:生成的I2在碱性溶液中不能存在。
设计实验b证实了假设2成立,实验b的操作及现象是
(4)某小组检验烧杯3所得溶液中含
 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
您最近一年使用:0次
2022-05-31更新
|
509次组卷
|
3卷引用:北京市第一六六中学2022届高三下学期三模化学试题



