名校
解题方法
1 . HX为一元弱酸,YOH为一元强碱。常温下,向难溶强电解质(YX)的悬浊液中加入某酸,测得c(Y+)与c(H+)的变化关系如图实线所示。下列说法错误的是
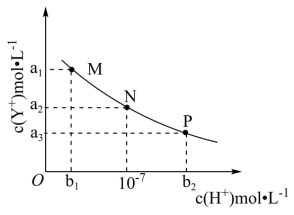

| A.M点时,c(X-)<c(Y+) |
| B.水的电离程度:N>P |
| C.实验时可加入的酸为盐酸 |
| D.难溶物YX的溶度积K为a22 |
您最近一年使用:0次
2021-12-30更新
|
1297次组卷
|
8卷引用:四川省成都市2021-2022学年高三上学期第一次诊断性检测理综化学试题
四川省成都市2021-2022学年高三上学期第一次诊断性检测理综化学试题(已下线)卷02 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)宁夏回族自治区石嘴山市平罗中学2022届高三第三次模拟理科综合化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型142 有关沉淀溶解平衡图像湖南省株洲市第二中学2023届高三第七次月考化学试题湖南省株洲市第一中学2023届高三第七次月考化学试题四川省双流棠湖中学2023-2024学年高三上学期10月月考理综化学试题
名校
2 . 室温下,将0.3molBaSO4加入5L1mol/LNa2CO3溶液中,不考虑体积变化,达到平衡时,c(SO )=0.02mol/L,下列说法错误的是
)=0.02mol/L,下列说法错误的是
 )=0.02mol/L,下列说法错误的是
)=0.02mol/L,下列说法错误的是| A.有BaCO3沉淀生成 |
| B.依据题干信息可推出:Ksp[BaSO4]<Ksp[BaCO3] |
| C.向溶液中继续加入少量Na2CO3固体,BaCO3沉淀增多 |
| D.向溶液中继续加入少量蒸馏水,BaCO3沉淀减少 |
您最近一年使用:0次
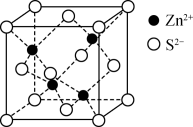
3 . 自然界中原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,遇到闪锌矿(ZnS)可慢慢转变为铜蓝(CuS)。已知: Ksp(ZnS)=2 ×10-22, Ksp(CuS)=6 ×10-36。下列说法正确的是

| A.Cu2+基态核外电子排布式为[Ar]3d84s1 |
B.反应ZnS(s)+Cu2+(ag)  CuS(s)+Zn2+(aq)正向进行,需满足 CuS(s)+Zn2+(aq)正向进行,需满足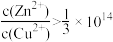 |
| C.ZnS 晶胞(见如图)中S2-的配位数为4 |
D.生成铜蓝后的溶液中一定存在: c(S2-)=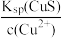 且c(S2- )> 且c(S2- )> 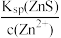 |
您最近一年使用:0次
名校
解题方法
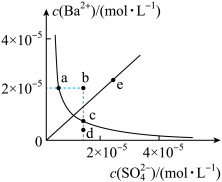
4 . 一定温度下, 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.加入一定量 固体,可使溶液由d点变到b点 固体,可使溶液由d点变到b点 |
B.加入一定量 固体,可使溶液由a点变到c点 固体,可使溶液由a点变到c点 |
| C.通过蒸发可以使不饱和溶液d变为饱和溶液c |
D.a、c点对应的 不同 不同 |
您最近一年使用:0次
2021-12-29更新
|
680次组卷
|
4卷引用:广东实验中学2021-2022学年高二上学期期中考试化学试题
名校
5 . 已知:①AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。
②室温下,Ksp(AgCl)=2.0×10-10,Ksp(Ag2S)=2.0×10-48。
向AgCl的悬浊液中加入一定量的Na2S溶液并振荡,白色固体向黑色固体转化。下列说法正确的是
②室温下,Ksp(AgCl)=2.0×10-10,Ksp(Ag2S)=2.0×10-48。
向AgCl的悬浊液中加入一定量的Na2S溶液并振荡,白色固体向黑色固体转化。下列说法正确的是
| A.Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(S2-) |
| B.向AgCl悬浊液加入足量氨水,溶液变澄清。反应的离子方程式为:AgCl+4NH3•H2O=[Ag(NH3)4]++Cl-+4H2O |
C.反应2AgCl+S2- Ag2S+2Cl-正向进行,需满足 Ag2S+2Cl-正向进行,需满足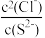 <2×1028 <2×1028 |
D.将转化后的体系静置,上层清液中离子存在关系:c(Ag+)=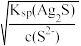 且c(Ag+)> 且c(Ag+)>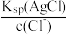 |
您最近一年使用:0次
2021-12-27更新
|
436次组卷
|
5卷引用:江苏省高邮市2021-2022学年高三上学期12月学情调研化学试题
江苏省高邮市2021-2022学年高三上学期12月学情调研化学试题(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)天津市耀华中学2022-2023学年高三上学期统练三 化学试题
6 . 化学与生产、生活密切相关,下列说法正确的是
| A.牙膏中添加氟化物可预防龋齿 |
| B.沼气的主要成分为甲烷,沼气属于不可再生资源 |
| C.葡萄酒中添加适量二氧化硫,可以起到抗氧化和漂白的作用 |
| D.氢氧化镁和碳酸钠可用作胃酸的中和剂 |
您最近一年使用:0次
2021-12-25更新
|
209次组卷
|
3卷引用:山西省2021-2022学年高二上学期12月联合考试化学试题
7 . T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
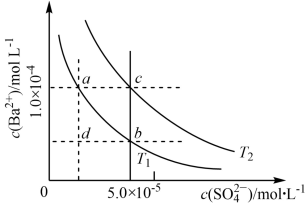
(1)T1___________ T2(填“>”“<”或“=”),T2温度时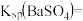
___________ 。
(2)根据T1温度时 的沉淀溶解平衡曲线,判断下列说法正确的是___________(填序号)。
的沉淀溶解平衡曲线,判断下列说法正确的是___________(填序号)。
(3)T2温度时,现有 的
的 沉淀,每次用
沉淀,每次用 饱和
饱和 溶液(浓度为
溶液(浓度为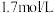 )处理。若使
)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理___ 次[提示: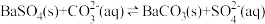 ,
,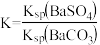 ,
,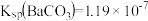 ]。
]。
(4) 与
与 都是难溶电解质,银白光亮的银器用久后表面易出现黑斑(Ag2S),利用电化学原理可处理黑斑。将银器置于含食盐水的铝制容器中并与铝接触,Ag2S转化为Ag,则正极的电极反应式为
都是难溶电解质,银白光亮的银器用久后表面易出现黑斑(Ag2S),利用电化学原理可处理黑斑。将银器置于含食盐水的铝制容器中并与铝接触,Ag2S转化为Ag,则正极的电极反应式为___________ 。

(1)T1
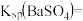
(2)根据T1温度时
 的沉淀溶解平衡曲线,判断下列说法正确的是___________(填序号)。
的沉淀溶解平衡曲线,判断下列说法正确的是___________(填序号)。A.加入 固体可由a点变为b点 固体可由a点变为b点 |
B.T1温度下,在T1曲线上方区域(不含曲线)的任意一点时,均有 沉淀生成 沉淀生成 |
| C.蒸发溶剂可能由d点变为T1,曲线上a、b之间(不含a、b)的某一点 |
| D.升温可由b点变为d点 |
 的
的 沉淀,每次用
沉淀,每次用 饱和
饱和 溶液(浓度为
溶液(浓度为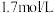 )处理。若使
)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理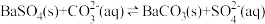 ,
,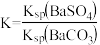 ,
,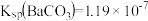 ]。
]。(4)
 与
与 都是难溶电解质,银白光亮的银器用久后表面易出现黑斑(Ag2S),利用电化学原理可处理黑斑。将银器置于含食盐水的铝制容器中并与铝接触,Ag2S转化为Ag,则正极的电极反应式为
都是难溶电解质,银白光亮的银器用久后表面易出现黑斑(Ag2S),利用电化学原理可处理黑斑。将银器置于含食盐水的铝制容器中并与铝接触,Ag2S转化为Ag,则正极的电极反应式为
您最近一年使用:0次
名校
8 . 下列有关说法正确的是
A. 溶液中: 溶液中: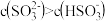 |
B.常温下,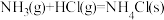 能自发的原因是 能自发的原因是 |
C.已知: ,保持温度不变,增大压强, ,保持温度不变,增大压强, 的浓度减小 的浓度减小 |
D.向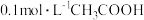 溶液中加适量水,导致溶液中 溶液中加适量水,导致溶液中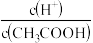 减小 减小 |
您最近一年使用:0次
2021-12-25更新
|
301次组卷
|
2卷引用:江苏省昆山市七校2021-2022学年高二上学期12月联考化学试题
9 . 室温下,通过下列实验探究NaHSO3溶液的性质:
下列有关说法正确的是
| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测定某NaHSO3溶液的pH,测得pH约为6 |
| 2 | 向某NaHSO3溶液中加入过量的Ba(OH)2溶液,产生白色沉淀 |
| 3 | 向某NaHSO3溶液中加入等体积等浓度的烧碱溶液,测得溶液pH约为9 |
| 4 | 向某苏打溶液中滴加几滴NaHSO3溶液,未观察到明显实验现象 |
A.NaHSO3溶液中存在c(OH-)=c(H+)-c(SO )+c(HSO )+c(HSO ) ) |
B.实验2反应静置后的上层清液中有c(Ba2+)×c(SO )>Ksp(BaSO3) )>Ksp(BaSO3) |
C.实验3得到的溶液中有c(Na+)=c(SO )+c(HSO )+c(HSO )+c(H2SO3) )+c(H2SO3) |
D.实验4中反应的离子方程式为CO +HSO +HSO =HCO =HCO +SO +SO |
您最近一年使用:0次
名校
10 . CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如图:
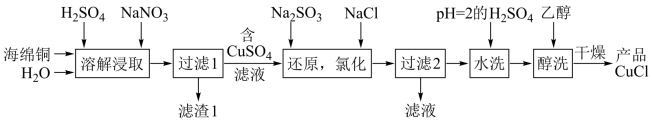
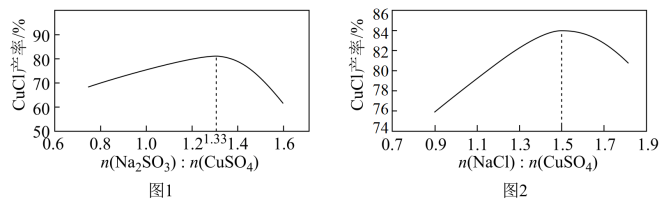
(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___ 。
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___ 。
③当1.0<n(NaCl):n(CuSO4)<1.5时,比值越大CuCl产率越大,结合沉淀平衡移动原理分析其原因是___ 。
(2)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为___ 。
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O 被还原为Cr3+,求样品中CuCl的质量分数
被还原为Cr3+,求样品中CuCl的质量分数___ (写计算过程)。

(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。

①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl):n(CuSO4)<1.5时,比值越大CuCl产率越大,结合沉淀平衡移动原理分析其原因是
(2)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O
 被还原为Cr3+,求样品中CuCl的质量分数
被还原为Cr3+,求样品中CuCl的质量分数
您最近一年使用:0次
2021-12-22更新
|
745次组卷
|
7卷引用:江苏省前黄高级中学、如东中学、姜堰中学2021-2022学年高三上学期12月份阶段性测试化学试题
江苏省前黄高级中学、如东中学、姜堰中学2021-2022学年高三上学期12月份阶段性测试化学试题江苏省姜堰中学、如东中学、前黄中学三校2021- 2022学年高三联考化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省徐州市第七中学2021-2022学年高三下学期2月检测化学试题湖南省益阳市第一中学2021-2022学年高二下学期期末考试化学试题(已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(实验探究题)



