1 . 为探究Fe3+能去否除银镜反应后试管壁上银镜进行了如下实验。
(常温下溶解度:AgCl :1.9×10-4g;Ag2SO4:0.796g)
下列说法不正确的是
序号 | 操作 | 现象 |
实验① | 将2mL 2mo/L Fe(NO3)3溶液(pH=1)加入有银镜的试管中 | 银镜消失 |
实验② | 将2mL 1mol/LFe2(SO4)3溶液(pH=1)加入有银镜的试管中 | 银镜减少,未消失 |
实验③ | 将2mL 2mol/L FeCl3溶液(pH=1)加入有银镜的试管中 | 银镜消失 |
下列说法不正确的是
| A.①中可能发生反应:Fe3++Ag=Fe2++Ag+ |
| B.实验①可以证明本条件下氧化性Fe3+>Ag+ |
| C.实验②和③的试管中可能有白色沉淀生成 |
D.实验②和③现象的差异与溶液中Cl-和 有关 有关 |
您最近一年使用:0次
名校
解题方法
2 . MSO4和MCO3是两种难溶性盐。常温时两种物质的溶解度曲线如图所示,下列叙述错误的是
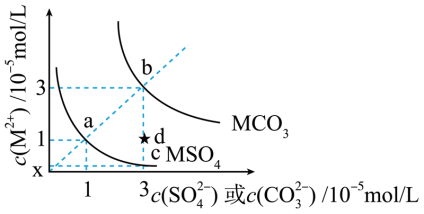

| A.Ksp(MCO3)=9.0×10−10 |
| B.c点的纵坐标0.33 |
| C.在饱和的MCO3澄清溶液里加入适量的Na2SO4固体,可使b点变为d点 |
| D.使1L含1molMSO4的悬浊液中的分散质完全转化为MCO3,需要加1molNa2CO3固体 |
您最近一年使用:0次
2021-03-03更新
|
901次组卷
|
7卷引用:新疆维吾尔自治区2021届高三第二次联考理科综合能力测试化学试卷
新疆维吾尔自治区2021届高三第二次联考理科综合能力测试化学试卷(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)T13-溶液中的离子平衡(已下线)云南省昆明市官渡区第二中学2023-2024学年高三上学期开学化学试题
解题方法
3 . 海洋是一个十分巨大的资源宝库,海水中含量最多的是H、O两种元素,还含有Na、Cl、Mg、Br、Ca、S等元素。海水资源的利用主要包括海水淡化、海水晒盐,从海水中制取镁、钾、溴等化工产品。从海水中提取镁的步骤是将石灰乳加入海水沉淀池中,得到氢氧化镁沉淀,再将氢氧化镁与盐酸反应,得到的溶液蒸发结晶,获得六水合氯化镁晶体(MgCl2•6H2O)进一步操作得到无水氯化镁,电解熔融氯化镁可获得单质镁。海水淡化是解决淡水资源短缺的有效途径之一,其方法主要有蒸馏法、电渗析法和离子交换法等。下列有关海水提镁的说法正确的是
| A.得到Mg(OH)2沉淀的化学反应方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl |
B.加入盐酸,Mg(OH)2(s) Mg2+(aq)+2OH-(aq)平衡正向移动 Mg2+(aq)+2OH-(aq)平衡正向移动 |
| C.在空气中加热灼烧MgCl2•6H2O可得到无水氯化镁 |
| D.电解熔融氯化镁时金属镁在阳极析出 |
您最近一年使用:0次
2021-02-24更新
|
413次组卷
|
2卷引用:江苏省六市(南通、淮安、泰州、徐州、镇江、宿迁)2021届高三一模化学试卷
解题方法
4 . Na2S2O4 (保险粉)是一种强还原剂,锌粉法制备Na2S2O4的原理为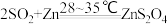 、
、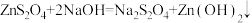 ,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
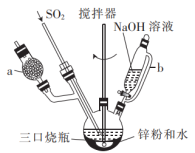
(1)仪器a中盛放的药品是___________ (填名称),导管b的作用是___________ 。
(2)实验开始前,需要向三口烧瓶中充满N2,目的是___________ 。
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为___________ 。
(4)制备Na2S2O4时,三口烧瓶的加热方式是___________ 。
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是___________ ,酒精洗涤的目的是___________ 。
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用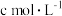 的
的 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗 标准溶液V mL。
标准溶液V mL。
已知: 被还原为
被还原为 ,
,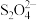 被氧化为
被氧化为 。
。
①滴定反应的离子方程式为___________ 。
②产品中Na2S2O4的质量分数为___________ 。(列出计算式)。
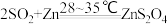 、
、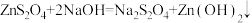 ,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
(1)仪器a中盛放的药品是
(2)实验开始前,需要向三口烧瓶中充满N2,目的是
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为
(4)制备Na2S2O4时,三口烧瓶的加热方式是
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用
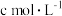 的
的 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗 标准溶液V mL。
标准溶液V mL。已知:
 被还原为
被还原为 ,
,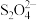 被氧化为
被氧化为 。
。①滴定反应的离子方程式为
②产品中Na2S2O4的质量分数为
您最近一年使用:0次
2021-01-21更新
|
569次组卷
|
4卷引用:陕西省安康市2021届高三第一次教学质量联考化学试题
陕西省安康市2021届高三第一次教学质量联考化学试题陕西省宝鸡市陈仓区2021届高三第二次教学质量检测理科综合化学试题(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)重点4 物质制备分析-2021年高考化学【热点·重点·难点】专练(新高考)
名校
5 . 草酸钙具有优异光学性能.在水中的沉淀溶解平衡曲线如图所示(T1>T2).已知T1时Ksp(CaC2O4)=6.7×10-4.下列说法错误的是
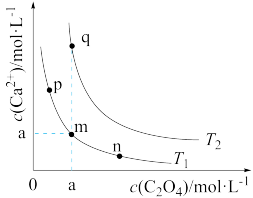

| A.图中a的数量级为10-2 |
| B.升高温度,m点的饱和溶液的组成由m沿mq线向q方向移动 |
| C.恒温条件下,向m点的溶液加入少量Na2C2O4固体,溶液组成由m沿曲线向n方向移动 |
| D.T1时,将浓度均为0.03mol/L的草酸钠和氯化钙溶液等体积混合,不能观察到沉淀 |
您最近一年使用:0次
2021-01-19更新
|
1186次组卷
|
6卷引用:广东省佛山市2021届普通高中高三教学质量检测(一模)化学试题
广东省佛山市2021届普通高中高三教学质量检测(一模)化学试题(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)化学-2023年高考押题预测卷01(浙江卷)(含考试版、全解全析、参考答案、答题卡)浙江省杭州第二中学2023届高三下学期3月月考化学试题广东省广州市协和中学等3校2022-2023学年高二上学期(12月)期末考试化学试题(已下线)T12-难溶电解质的沉淀溶解平衡
解题方法
6 . 已知:25℃时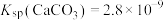 ,常温时,
,常温时, 在水中的溶解平衡曲线如图所示,下列叙述错误的是
在水中的溶解平衡曲线如图所示,下列叙述错误的是
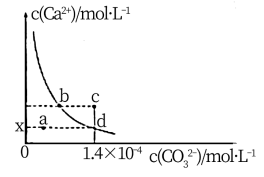
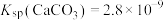 ,常温时,
,常温时, 在水中的溶解平衡曲线如图所示,下列叙述错误的是
在水中的溶解平衡曲线如图所示,下列叙述错误的是
A.加入少量的 固体可使溶液由a点变到d点 固体可使溶液由a点变到d点 |
| B.加入蒸馏水可使澄清溶液由b点变到d点 |
| C.c点液体经静置会变到曲线上b、d之间的某点 |
| D.曲线上的各点对应溶液的溶质可能不相同 |
您最近一年使用:0次
解题方法
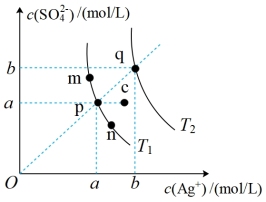
7 . 已知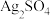 在水中的沉淀溶解平衡曲线如图所示,且
在水中的沉淀溶解平衡曲线如图所示,且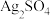 的溶解度随温度的升高而增大,下列说法正确的是
的溶解度随温度的升高而增大,下列说法正确的是
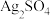 在水中的沉淀溶解平衡曲线如图所示,且
在水中的沉淀溶解平衡曲线如图所示,且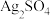 的溶解度随温度的升高而增大,下列说法正确的是
的溶解度随温度的升高而增大,下列说法正确的是
A.m、n、p、q四点溶液均为对应温度下的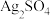 饱和溶液 饱和溶液 |
| B.向p点溶液中加入硝酸银固体,则p点可沿虚线移动到c点 |
C. 时,若 时,若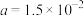 ,则 ,则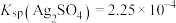 |
| D.温度降低时,q点饱和溶液的组成由q点沿qp虚线向p点方向移动 |
您最近一年使用:0次
名校
解题方法
8 . 下列叙述中正确的是
| A.NaHSO4固体溶于水时,只破坏了离子键 |
B.向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中 减小 减小 |
C.氨水与SO2反应恰好生成NH4HSO3时:c(H+)+c(H2SO3)=c(OH-)+c(SO )+c(NH3·H2O) )+c(NH3·H2O) |
| D.25℃时Cu(OH)2在水中的溶解度小于其在Cu(NO3)2溶液中的溶解度 |
您最近一年使用:0次
2020-12-10更新
|
330次组卷
|
2卷引用:福建省南安第一中学2021届高三第二次模拟考试化学试题
名校
9 . 以下实验设计能达到实验目的的是
| 选项 | 化合物成分(括号内为杂质) | 除杂方法 |
| A | SO2(HCl) | 将气体通入饱和食盐水溶液 |
| B | CuCl2溶液(FeCl3) | 加入过量CuO或Cu2(OH)2CO3静置后过滤 |
| C | 乙酸乙酯(乙酸) | 加入饱和NaOH溶液,振荡后静置分液 |
| D | NaCl溶液(KI) | 滴加新制氯水后,用CCl4萃取 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-08更新
|
699次组卷
|
5卷引用:天津市部分区2021届高三第一次质量调查化学试题
名校
解题方法
10 . 下列叙述正确的是( )
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| B.25℃时Ksp(AgCl)= 1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
| C.浓度均为0.1 mol/L的下列溶液,pH 由大到小的排列顺序为NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| D.为确定二元酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
您最近一年使用:0次
2020-09-12更新
|
389次组卷
|
5卷引用:福建省莆田二中、泉州一中、南安一中三校2020-2021学年高三下学期联考化学试题



