1 . FeAsO4在不同温度下的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法不正确的是
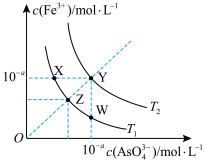

| A.温度为T2时,Ksp(FeAsO4)=10-2a |
| B.c(FeAsO4):Z>W=X |
| C.FeAsO4的溶解过程吸收能量 |
| D.将Z溶液升温一定可以得到Y溶液 |
您最近一年使用:0次
2021-04-22更新
|
668次组卷
|
7卷引用:黑龙江省齐齐哈尔市2021届高三第二次模拟考试理综化学试题
黑龙江省齐齐哈尔市2021届高三第二次模拟考试理综化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)难点6 水溶液中的四大平衡常数-2021年高考化学专练【热点·重点·难点】(已下线)作业10 沉淀溶解平衡-2021年高二化学暑假作业(人教版2019)(已下线)第26讲 难溶电解质的溶解平衡(精讲)-2022年一轮复习讲练测(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
2 . 锌冶炼过程中产生的锌渣主要成分为铁酸锌(ZnFe2O4)和二氧化硅,以及少量的铜、铁、锌的氧化物和硫化物。利用酸溶的方法可溶出金属离子,使锌渣得到充分利用。
(1)铁酸锌酸溶。铁酸锌难溶于水,其晶胞由A、B结构按照1∶1交替累积而成,如图所示。将铁酸锌粉末投入到1L1mol·L-1H2SO4中,保温80℃,匀速搅拌。浸出液中Fe3+和Zn2+的浓度随时间的变化如表所示。
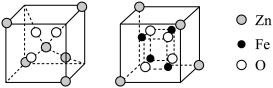
①B结构的化学式为___ 。
②铁酸锌和硫酸反应的离子方程式为___ 。
③酸溶时,溶出效率较高的金属离子是___ 。
(2)锌渣酸溶。将锌渣分别在SO2—1mol·L-1H2SO4、1mol·L-1H2SO4以及SO2—H2O三种体系中实验,均保持80℃,匀速搅拌,所得结果如图所示。已知:25℃时,Ksp(FeS)=6.3×10-17;Ksp(ZnS)=2.9×10-25;Ksp(CuS)=6.3×10-36;Ksp(Cu2S)=2.5×10-48;FeS和ZnS可溶于稀硫酸,CuS和Cu2S不溶于稀硫酸。
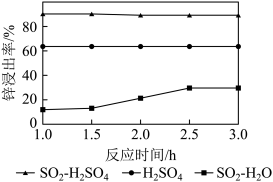
①在SO2—H2SO4体系中,Zn2+浸出率较高的原因是___ 。
②在SO2—H2SO4体系中,溶渣中Cu2S的质量增加,原因是___ 。
(1)铁酸锌酸溶。铁酸锌难溶于水,其晶胞由A、B结构按照1∶1交替累积而成,如图所示。将铁酸锌粉末投入到1L1mol·L-1H2SO4中,保温80℃,匀速搅拌。浸出液中Fe3+和Zn2+的浓度随时间的变化如表所示。

| 时间/h | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 |
| c(Zn2+)/mol•L-1 | 0.10 | 0.11 | 0.15 | 0.21 | 0.21 |
| c(Fe3+)/mol•L-1 | 0.12 | 0.13 | 0.16 | 0.21 | 0.30 |
②铁酸锌和硫酸反应的离子方程式为
③酸溶时,溶出效率较高的金属离子是
(2)锌渣酸溶。将锌渣分别在SO2—1mol·L-1H2SO4、1mol·L-1H2SO4以及SO2—H2O三种体系中实验,均保持80℃,匀速搅拌,所得结果如图所示。已知:25℃时,Ksp(FeS)=6.3×10-17;Ksp(ZnS)=2.9×10-25;Ksp(CuS)=6.3×10-36;Ksp(Cu2S)=2.5×10-48;FeS和ZnS可溶于稀硫酸,CuS和Cu2S不溶于稀硫酸。

①在SO2—H2SO4体系中,Zn2+浸出率较高的原因是
②在SO2—H2SO4体系中,溶渣中Cu2S的质量增加,原因是
您最近一年使用:0次
2021-04-21更新
|
628次组卷
|
4卷引用:江苏省苏锡常镇四市2021届高三教学情况调研(一)化学试题
江苏省苏锡常镇四市2021届高三教学情况调研(一)化学试题(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)江苏省南京市金陵中学2021-2022学年高三下学期3月学情调研化学试题江苏省泰州中学2023-2024学年高三上学期期初调研考试化学试题
解题方法
3 . 常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知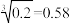 )。下列分析正确的是
)。下列分析正确的是

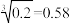 )。下列分析正确的是
)。下列分析正确的是
A.由图可知常温下 |
| B.饱和Ca(OH)2溶液中加入少量CaO,溶液变浑浊,但Ca2+离子数目不变 |
C.饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: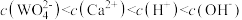 |
| D.d点的CaWO4溶液中,加入CaCl2固体,d点溶液组成沿da线向c点移动(假设混合后溶液体积不变) |
您最近一年使用:0次
名校
4 . 向等体积pH不同的盐酸和NH4Cl溶液中加入过量镁条,溶液pH和温度随时间变化曲线如图。下列有关说法错误的是
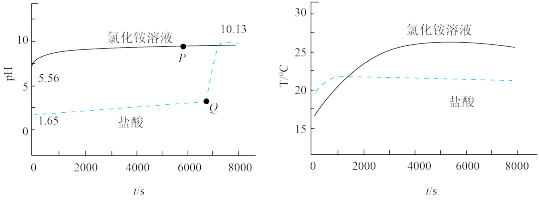

A.在NH4Cl溶液中,P点存在:2c(Mg2+)+c(NH )>c(Cl-) )>c(Cl-) |
| B.Ksp[Mg(OH)2]=5×10-12.61 |
| C.在NH4Cl溶液中,2000~4000温度上升是因为Mg与H2O发生反应 |
| D.在盐酸中,Q点后pH上升是因为Mg与HCl发生反应 |
您最近一年使用:0次
2021-04-11更新
|
549次组卷
|
2卷引用:福建省部分地区(南平、龙岩、三明、宁德、厦门)2021届高中毕业班4月质量检测化学试题
名校
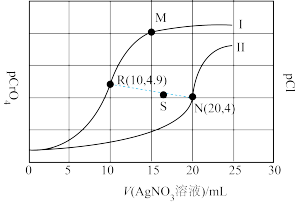
5 . 某温度下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的KCl溶液和K2CrO4溶液中滴加0.1 mol·L-1的AgNO3溶液,滴加过程中pCl和pCrO4随加入AgNO3溶液的体积(V)的变化关系如图所示。已知:pCl=-lgc(Cl-),pCrO4=-lgc( )。下列说法不正确的是
)。下列说法不正确的是
 )。下列说法不正确的是
)。下列说法不正确的是
| A.曲线I表示pCl与V(AgNO3溶液)的变化关系 |
| B.若仅增大KCl的浓度,平衡点由R点沿虚线移向S点 |
C.M点溶液中:c( )>c(Ag+)>c(H+)>c(OH-) )>c(Ag+)>c(H+)>c(OH-) |
| D.该温度下,Ksp(Ag2CrO4)=4.0×10-12 |
您最近一年使用:0次
2021-04-06更新
|
1193次组卷
|
6卷引用:贵州省黔东南州2021届高三下学期3月高考模拟考试理综化学试题
贵州省黔东南州2021届高三下学期3月高考模拟考试理综化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)安徽省舒城中学2021-2022学年高二下学期第一次月考化学试题(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
解题方法
6 . 下列说法正确的是
A.常温下, 相等的 相等的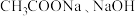 和 和 三种溶液: 三种溶液: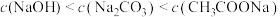 |
B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②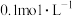 盐酸③ 盐酸③ 氯化镁溶液④ 氯化镁溶液④ 硝酸银溶液中 硝酸银溶液中 的浓度:①>③>②=④ 的浓度:①>③>②=④ |
C. 的 的 溶液,其 溶液,其 ,则 ,则 |
D. 的 的 溶液与 溶液与 的 的 溶液等体积混合: 溶液等体积混合: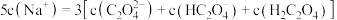 |
您最近一年使用:0次
7 . 一种从阳极泥(主要成分为 Cu、Ag、Pt、Au、Ag2Se和Cu2S等)中回收 Se和贵重金属的工艺流程如下图所示。
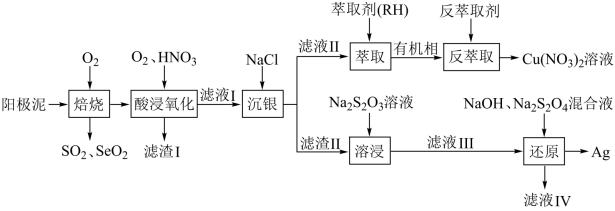
已知:①该工艺中萃取与反萃取原理为: ;
;
② 易与 Ag+形成配离子:
易与 Ag+形成配离子: ,常温下该反应的平衡常数
,常温下该反应的平衡常数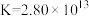 。
。
回答下列问题:
(1)“焙烧”产生的SO2与 SeO2的混合烟气可用水吸收制得单质 Se,该反应的化学方程式为_______ 。
(2)“滤渣Ⅰ”的主要成分是_______ ;“酸浸氧化”中通入氧气的目的是_______ 。
(3)“反萃取剂”最好选用_______ (填化学式)溶液。
(4)“溶浸”中发生的反应为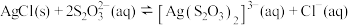 ,该反应的平衡常数K'=
,该反应的平衡常数K'=_______ 。[已知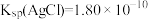 ]
]
(5)“滤液IV”中含有 Na2SO3,则“还原”中发生反应的离子方程式为_______ ;“滤液 IV”可返回“溶浸”工序循环使用,但循环多次后,银的浸出率会降低,原因是_______ (试用平衡原理解释)。

已知:①该工艺中萃取与反萃取原理为:
 ;
;②
 易与 Ag+形成配离子:
易与 Ag+形成配离子: ,常温下该反应的平衡常数
,常温下该反应的平衡常数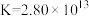 。
。回答下列问题:
(1)“焙烧”产生的SO2与 SeO2的混合烟气可用水吸收制得单质 Se,该反应的化学方程式为
(2)“滤渣Ⅰ”的主要成分是
(3)“反萃取剂”最好选用
(4)“溶浸”中发生的反应为
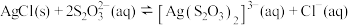 ,该反应的平衡常数K'=
,该反应的平衡常数K'=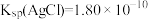 ]
](5)“滤液IV”中含有 Na2SO3,则“还原”中发生反应的离子方程式为
您最近一年使用:0次
2021-03-11更新
|
780次组卷
|
3卷引用:山东省临沂市2021届高三第一次模拟考试化学试题
山东省临沂市2021届高三第一次模拟考试化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题(已下线)专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】
8 . 研究含铅废水的处理具有重要意义。向含 Pb2+的废水中逐滴滴加 NaOH溶液,溶液变浑浊,继续滴加 NaOH 溶液又变澄清。溶液中 Pb2+及其与 OH-形成的微粒的浓度分数(α)随溶液 pH 变化的关系如图所示。下列说法正确的是
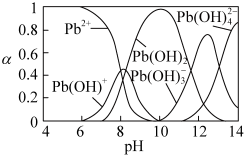
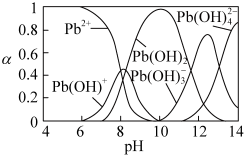
| A.Pb2+的浓度分数先减小后增大 |
| B.除去溶液中的 Pb2+,应将溶液的pH调至约为10 |
| C.pH=7时,溶液中的阳离子仅有Pb2+和Pb(OH)+ |
D.pH≥13 时,溶液中发生的主要反应为: |
您最近一年使用:0次
2021-03-11更新
|
824次组卷
|
3卷引用:山东省临沂市2021届高三第一次模拟考试化学试题
山东省临沂市2021届高三第一次模拟考试化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题(已下线)专题10 水溶液中的离子平衡-备战2022年高考化学真题及地市好题专项集训【山东专用】
解题方法
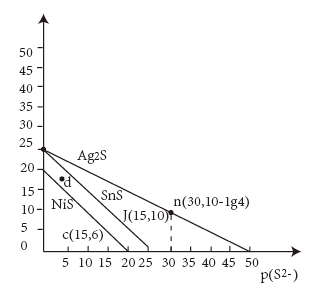
9 . 一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵轴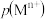 表示
表示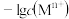 ,横轴
,横轴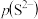 表示
表示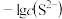 ,下列说法错误的是
,下列说法错误的是
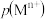 表示
表示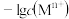 ,横轴
,横轴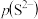 表示
表示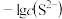 ,下列说法错误的是
,下列说法错误的是
A.该温度下, 的 的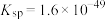 |
B. 点表示该温度下 点表示该温度下 的不饱和溶液 的不饱和溶液 |
C.该温度下, 和 和 的饱和溶液中 的饱和溶液中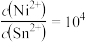 |
D.向含有等物质的量浓度的 、 、 、 、 溶液中加入饱和 溶液中加入饱和 溶液,析出沉淀的先后顺序为 溶液,析出沉淀的先后顺序为 、 、 、 、 |
您最近一年使用:0次
名校
10 . 辉铜矿(主要成分是Cu2S)是提炼铜的重要矿物原料之一、以H2O2作为氧化剂在硫酸环境中对辉铜矿浸出生成CuSO4的模型如下:
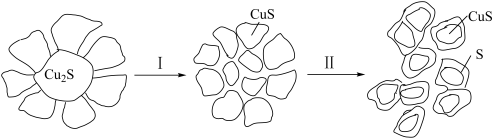
(1)根据上述转化关系,请回答。
①I和Ⅱ的转化过程中,被氧化的元素是_______ 。
②将过程Ⅰ的化学方程式补充完整:Cu2S+H2O2+_____=CuS+_____+____,_______ 。
③过程Ⅱ中,H2O2起主要作用,但加入Fe2(SO4)3可以提高浸出率。过程Ⅱ的浸出模型如图。结合难溶电解质的溶解平衡,解释加入Fe2(SO4)3的作用_______ 。
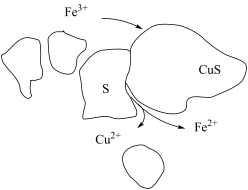
④在浸出过程中,Fe3+可以不断再生,其离子方程式是_______ 。
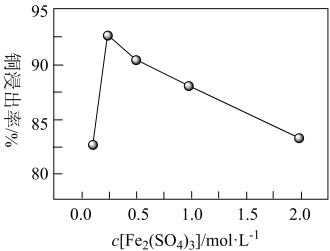
⑤在相同时间内,测得Fe2(SO4)3浓度对Cu2+浸出率的影响如下图所示。当c[Fe2(SO4)3]>0.25mol·L-1后,图中曲线下降的可能原因是_______ 。
(2)测定浸出液中Cu2+浓度,其过程如下:
i.取a mL浸出液,煮沸除尽过量H2O2,调节溶液的酸度。加入KF(除去Fe3+);
ii.加入过量KI溶液,与Cu2+反应生成CuI白色沉淀和I2
iii.用0.1000mol·L-1 Na2S2O3标准溶液滴定生成的I2,消耗Na2S2O3镕液b mL。(已知: )
)
①ii中反应的离子方程式是_______ 。
②浸出液中的c(Cu2+)=_____________ mol∙L-1。

(1)根据上述转化关系,请回答。
①I和Ⅱ的转化过程中,被氧化的元素是
②将过程Ⅰ的化学方程式补充完整:Cu2S+H2O2+_____=CuS+_____+____,
③过程Ⅱ中,H2O2起主要作用,但加入Fe2(SO4)3可以提高浸出率。过程Ⅱ的浸出模型如图。结合难溶电解质的溶解平衡,解释加入Fe2(SO4)3的作用

④在浸出过程中,Fe3+可以不断再生,其离子方程式是
⑤在相同时间内,测得Fe2(SO4)3浓度对Cu2+浸出率的影响如下图所示。当c[Fe2(SO4)3]>0.25mol·L-1后,图中曲线下降的可能原因是

(2)测定浸出液中Cu2+浓度,其过程如下:
i.取a mL浸出液,煮沸除尽过量H2O2,调节溶液的酸度。加入KF(除去Fe3+);
ii.加入过量KI溶液,与Cu2+反应生成CuI白色沉淀和I2
iii.用0.1000mol·L-1 Na2S2O3标准溶液滴定生成的I2,消耗Na2S2O3镕液b mL。(已知:
 )
)①ii中反应的离子方程式是
②浸出液中的c(Cu2+)=
您最近一年使用:0次
2021-03-06更新
|
342次组卷
|
3卷引用:北京市2021届高三下学期综合能力测试化学试题



