名校
解题方法
1 . 利用含钴废料(主要成分为 ,还含有少量的铝箔、
,还含有少量的铝箔、 等杂质)制备碳酸钴的工艺流程如图:
等杂质)制备碳酸钴的工艺流程如图: 的反应原理:
的反应原理: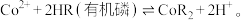 下列说法错误的是
下列说法错误的是
 ,还含有少量的铝箔、
,还含有少量的铝箔、 等杂质)制备碳酸钴的工艺流程如图:
等杂质)制备碳酸钴的工艺流程如图: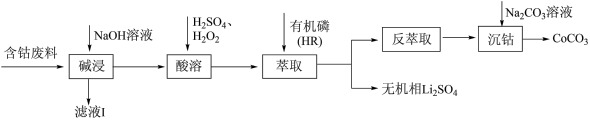
 的反应原理:
的反应原理: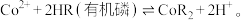 下列说法错误的是
下列说法错误的是A.“滤液Ⅰ”中溶质的主要成分是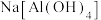 |
B.“反萃取”中可加入 分离出 分离出 |
C.“酸溶”反应中 可以换成 可以换成 |
D.为提高产品的纯度,“沉钴”时 溶液滴加速率不宜过快 溶液滴加速率不宜过快 |
您最近一年使用:0次
2024-01-08更新
|
436次组卷
|
3卷引用:江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷
江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷 福建省泉州市第七中学2023-2024学年高三上学期期中考试化学试题 (已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
2 . 下列实验装置(部分夹持装置已略去)能达到对应实验目的的是


| A.用图甲测定中和热 |
| B.用装置乙作为分馏的接收装置 |
C.图丙比较 和 和 溶解度大小 溶解度大小 |
| D.图丁探究铁的吸氧腐蚀 |
您最近一年使用:0次
名校
解题方法
3 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
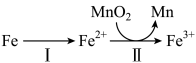
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
您最近一年使用:0次
2023-12-15更新
|
183次组卷
|
3卷引用:江西省上饶市广丰一中2023-2024学年高二上学期12月考试化学试卷
名校
4 . 常温下,用 溶液分别滴定浓度均为0.01 mol⋅L
溶液分别滴定浓度均为0.01 mol⋅L 的KCl、
的KCl、 溶液,所得的沉淀溶解平衡图像如图所示(不考虑
溶液,所得的沉淀溶解平衡图像如图所示(不考虑 的水解)。
的水解)。
 溶液分别滴定浓度均为0.01 mol⋅L
溶液分别滴定浓度均为0.01 mol⋅L 的KCl、
的KCl、 溶液,所得的沉淀溶解平衡图像如图所示(不考虑
溶液,所得的沉淀溶解平衡图像如图所示(不考虑 的水解)。
的水解)。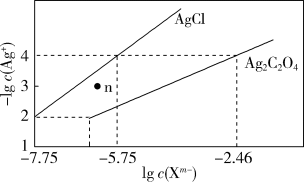
A. 的数量级等于 的数量级等于 |
| B.n点表示AgCl的饱和溶液 |
C.向浓度相同的KCl、 混合溶液中滴入 混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
D.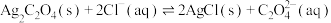 的平衡常数为 的平衡常数为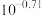 |
您最近一年使用:0次
2023-12-02更新
|
368次组卷
|
3卷引用:江西省上饶市婺源县天佑中学2023-2024学年高二上学期12月考试化学试题
名校
解题方法
5 . 已知25℃物质的溶度积常数为:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS: Ksp=1.6×10-24。下列说法错误的是
| A.相同温度下,CuS的溶解度小于ZnS的溶解度 |
| B.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
| C.0.01molCuSO4完全溶解在1L 0.023mol/L的Na2S溶液中,Cu2+浓度为1.0×10-34mol/L |
| D.在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
您最近一年使用:0次
2023-11-24更新
|
261次组卷
|
2卷引用:江西省鹰潭市2023-2024学年高二上学期1月期末考试化学试题
名校
6 . 下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 乙烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的有机物具有酸性 |
| B | 46 g乙醇与足量Na反应生成1 g H2 | 乙醇分子中氢氧键比碳氢键更易断裂 |
| C | 酰胺在酸或碱存在并加热时可水解 | 氨基酸有两性,能发生反应生成肽键 |
| D | FeS去除工业废水中的Hg2+、Cu2+ | FeS具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 钕铁硼废料是一种具有较高经济价值的废弃物,主要成分为稀土元素钕(Nd)、Fe、B.一种采用分步沉淀从钕铁硼油泥中回收Nd2(C2O4)3·10H2O和FeC2O4·2H2O的工艺流程如图:
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择___________ (填化学式)溶液。
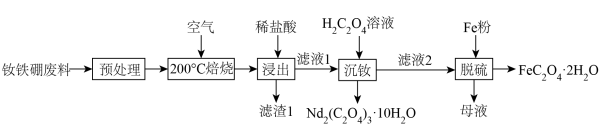
(2)“滤渣1”的主要成分是___________ (填名称)。“浸出”时,盐酸浓度和液固比对钕、铁的浸出率影响如图所示,则浸出过程的最佳条件是___________ 。___________ 。
(4)“沉铁”时,加入铁粉的作用是___________ 。
(5)FeC2O4·2H2O晶体结构片段如图所示。___________ ;碳原子采用___________ 杂化。现测定草酸亚铁晶体纯度。准确称取Wg样品于锥形瓶,加入适量的稀硫酸,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液bmL。滴定反应: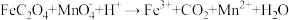 (未配平)。该样品纯度为
(未配平)。该样品纯度为___________ %。
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择
(2)“滤渣1”的主要成分是
(4)“沉铁”时,加入铁粉的作用是
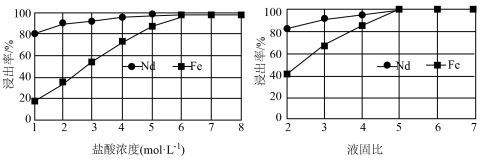
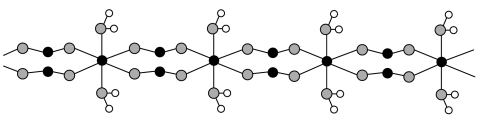
(5)FeC2O4·2H2O晶体结构片段如图所示。
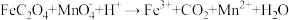 (未配平)。该样品纯度为
(未配平)。该样品纯度为
您最近一年使用:0次
2023-11-01更新
|
1047次组卷
|
5卷引用:2024届江西省南昌市第十九中学高三下学期模拟预测化学试题
名校
解题方法
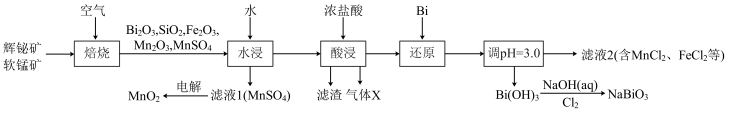
8 . 铋酸钠( )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性: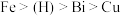 。
。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1) 中Bi的化合价为
中Bi的化合价为___________ 。气体X是___________ (填化学式)。
(2)“焙烧”中 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:___________ 。被还原的元素是___________ (填元素符号)。
(3)“还原”中Bi的作用是___________ 。
(4)检验滤液2中是否有 的试剂是
的试剂是___________ (填化学式)。
(5)已知 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:___________ 。
(6)为探究 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:
___________  (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是___________ 。
 )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性:
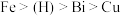 。
。②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.5 | 2.8 |
 | 6.3 | 8.3 |
 | 8.1 | 10.1 |
(1)
 中Bi的化合价为
中Bi的化合价为(2)“焙烧”中
 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:(3)“还原”中Bi的作用是
(4)检验滤液2中是否有
 的试剂是
的试剂是(5)已知
 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:(6)为探究
 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:
实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:

 (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是
您最近一年使用:0次
2023-10-19更新
|
198次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
9 . 一种废镍催化剂中含有Ni、Al、Cr、Cu、FeS及碳粉,以其为原料制备环烷酸镍[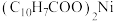 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
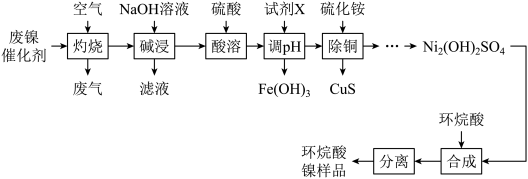
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“灼烧”后Cr转化为 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、___________ 。基态Cr原子的价层电子排布式为___________ 。
(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是___________ 。
(3)“调pH”时,溶液pH的范围为___________ 。
(4)常温下,CuS的 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
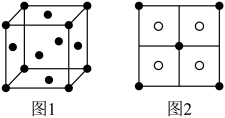
①与 距离最近的
距离最近的 数目为
数目为___________ 。
②CuS的晶胞参数为apm,阿伏加德罗常数的值为 ,则CuS晶体的密度为
,则CuS晶体的密度为___________  。
。
(5)环烷酸的化学式为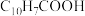 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:___________ 。
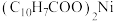 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.9 | 7.0 | 6.4 | 5.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 8.4 | 6.7 |
(1)“灼烧”后Cr转化为
 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是
(3)“调pH”时,溶液pH的范围为
(4)常温下,CuS的
 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与
 距离最近的
距离最近的 数目为
数目为②CuS的晶胞参数为apm,阿伏加德罗常数的值为
 ,则CuS晶体的密度为
,则CuS晶体的密度为 。
。(5)环烷酸的化学式为
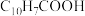 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:
您最近一年使用:0次
2023-10-16更新
|
244次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
10 . 废旧铅蓄电池会导致铅污染,回收铅的流程如图所示。
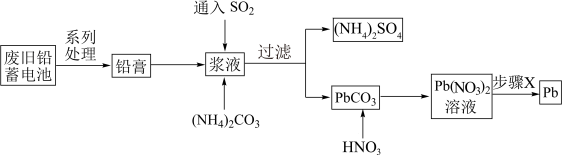
| A.SO2的作用是将PbO2还原成PbSO4 |
B.加入(NH4)2CO3后发生的反应为:PbSO4(s)+CO (aq) (aq) PbCO3(s)+SO PbCO3(s)+SO (aq) (aq) |
| C.步骤X可以是蒸干灼烧 |
| D.若步骤X为电解,则整个流程中,HNO3可循环使用 |
您最近一年使用:0次
2023-09-17更新
|
606次组卷
|
5卷引用:2024届南昌市第十九中学高三下学期模拟预测化学试题



