名校
解题方法
1 . 下列指定反应的离子方程式正确的是
A.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH +H++SO +H++SO =BaSO4↓+NH3·H2O+H2O =BaSO4↓+NH3·H2O+H2O |
B.向PbS固体中滴加硫酸铜溶液:Cu2++SO +PbS=CuS+PbSO4 +PbS=CuS+PbSO4 |
| C.将Fe(OH)3固体溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
D.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO |
您最近一年使用:0次
2022-05-05更新
|
971次组卷
|
7卷引用:江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题
江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题东北育才学校超常教育实验部(少32届)2022届高三第十次模拟考试化学试题(已下线)专题03离子反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题03离子反应-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题03离子反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题03 离子反应-三年(2020-2022)高考真题分项汇编湖南省永州市第一中学2023届高三下学期第五次月考化学试题
解题方法
2 . 下列有关实验操作、现象及结论都正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 溶液变蓝色 | Fe3+的氧化性比I2的强 |
| B | 将淀粉和稀硫酸混合加热一段时间后,再加入新制的Cu(OH)2悬浊液,加热 | 产生砖红色沉淀 | 淀粉在稀硫酸、加热条件下水解为葡萄糖 |
| C | 取一支试管装入2 mL2 mol/LNaOH溶液,先滴加1 mL1 mol/LMgCl2溶液,溶液再滴加几滴1mol/LCuCl2 | 先生成白色沉淀,后沉淀变为蓝色 | Ksp[Cu(OH)2<Ksp[Mg(OH)2 |
| D | 两支试管各盛4mL0.1mol/L酸性高锰酸钾溶液,分别加入2mL0.1mol/L的草酸溶液和2mL0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液完全褪色时间更短 | 反应物浓度越大,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 一种从废旧锂电池(主要含 ,及少量Al、Cu中制备钴酸钾(
,及少量Al、Cu中制备钴酸钾( )的工艺流程如下;
)的工艺流程如下;
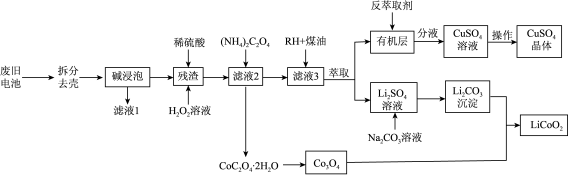
查阅资料: 具有很强的氧化性
具有很强的氧化性
(1)“碱浸泡”用来除去废旧电池中的Al,为提高该物质的去除率可采取的措施有___________ (任写一条)。
(2)向“残渣"中加入稀硫酸和 ,写出
,写出 参与反应的化学方程式
参与反应的化学方程式___________ 。
(3)向“滤液2”中加入沉淀剂时,若不采用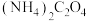 而采用
而采用 ,产物中会混有
,产物中会混有 ,试分析原因
,试分析原因___________ 。
(4)RH蒸取 的原理可表示为:
的原理可表示为: 。实验室进行萃取实验用到的玻璃仪器是
。实验室进行萃取实验用到的玻璃仪器是___________ ;向有机层中加入反萃取剂___________ (填化学式)可将 反萃取至水层。
反萃取至水层。
(5)某 样品中可能含有的杂质为
样品中可能含有的杂质为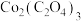 、
、 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取m g样品于锥形瓶中,加入稀 溶解,水浴加热至75℃,用c
溶解,水浴加热至75℃,用c  的
的 溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗
溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗 溶液
溶液 mL。
mL。
Ⅱ.向上述溶液中加入适量还原剂将 完全还原为
完全还原为 ,加入稀
,加入稀 后,在75℃继续用c
后,在75℃继续用c 
 溶液滴定至溶液出现粉红色且30s内不褪色,又消耗
溶液滴定至溶液出现粉红色且30s内不褪色,又消耗 溶液
溶液 mL。
mL。
样品中所含 (
( )的质量分数表达式为
)的质量分数表达式为___________ 。若盛装 溶液的滴定管没有润洗,则测得样品中Co元素含量
溶液的滴定管没有润洗,则测得样品中Co元素含量___________ 。(填“偏高”、“偏低”、“无影响”)
 ,及少量Al、Cu中制备钴酸钾(
,及少量Al、Cu中制备钴酸钾( )的工艺流程如下;
)的工艺流程如下;
查阅资料:
 具有很强的氧化性
具有很强的氧化性(1)“碱浸泡”用来除去废旧电池中的Al,为提高该物质的去除率可采取的措施有
(2)向“残渣"中加入稀硫酸和
 ,写出
,写出 参与反应的化学方程式
参与反应的化学方程式(3)向“滤液2”中加入沉淀剂时,若不采用
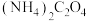 而采用
而采用 ,产物中会混有
,产物中会混有 ,试分析原因
,试分析原因(4)RH蒸取
 的原理可表示为:
的原理可表示为: 。实验室进行萃取实验用到的玻璃仪器是
。实验室进行萃取实验用到的玻璃仪器是 反萃取至水层。
反萃取至水层。(5)某
 样品中可能含有的杂质为
样品中可能含有的杂质为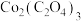 、
、 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:Ⅰ.取m g样品于锥形瓶中,加入稀
 溶解,水浴加热至75℃,用c
溶解,水浴加热至75℃,用c  的
的 溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗
溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗 溶液
溶液 mL。
mL。Ⅱ.向上述溶液中加入适量还原剂将
 完全还原为
完全还原为 ,加入稀
,加入稀 后,在75℃继续用c
后,在75℃继续用c 
 溶液滴定至溶液出现粉红色且30s内不褪色,又消耗
溶液滴定至溶液出现粉红色且30s内不褪色,又消耗 溶液
溶液 mL。
mL。样品中所含
 (
( )的质量分数表达式为
)的质量分数表达式为 溶液的滴定管没有润洗,则测得样品中Co元素含量
溶液的滴定管没有润洗,则测得样品中Co元素含量
您最近一年使用:0次
4 . 下列有关说法正确的是
| A.使用广泛pH试纸测量“84”消毒液的pH |
B.反应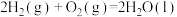 在一定条件能自发进行的原因是 在一定条件能自发进行的原因是 |
C.常温下,将稀 溶液加水稀释后,恢复至原温度,pH减小、 溶液加水稀释后,恢复至原温度,pH减小、 不变 不变 |
D.常温下,向 悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小 悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小 |
您最近一年使用:0次
名校
5 . 下列有关实验操作的解释或结论正确的是
| 实验操作 | 解释或结论 | |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2 固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 加热石蜡油,将产生的气体通入酸性高锰酸钾,溶液褪色 | 证明反应一定生成了乙烯 |
| C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果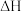 偏大 偏大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 以碳酸锰铜矿(主要成分为MnCO3、CuCO3,还含有Fe2O3、FeO等杂质)为原料制备硫酸锰的一种工艺流程如下:
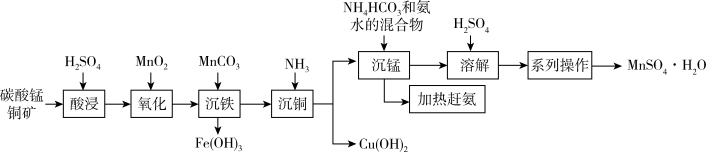
(1)“氧化”时,反应的离子方程式为_______ 。可用一种试剂检验氧化后的溶液中是否含有Fe2+,该试剂为_______ (写化学式)。
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为_______ 。
(3)“沉铜"时,若滤液中c(Mn2+)=0.21mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为_______ 。[已知:常温下,Ksp[Cu(OH)2]=1×10-20,Ksp[Mn(OH)2]=2.1×10-13,离子浓度小于或等于10-5mol/L可视为沉淀完全]
(4)本工艺中可循环使用的物质是_______ 。
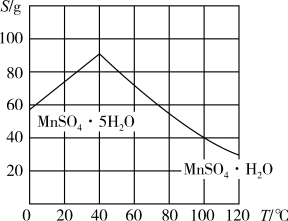
(5)结合图象,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:_______ 、_______ ,酒精洗涤,低温干燥。

(1)“氧化”时,反应的离子方程式为
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为
(3)“沉铜"时,若滤液中c(Mn2+)=0.21mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为
(4)本工艺中可循环使用的物质是
(5)结合图象,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:

您最近一年使用:0次
2022-04-13更新
|
712次组卷
|
6卷引用:江西省九江市2022届第二次高考模拟统一考试理综化学试题
江西省九江市2022届第二次高考模拟统一考试理综化学试题江西省安义中学2022-2023学年高三上学期中考试化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
7 . 常温下,几种难溶物的溶度积常数如下表所示。下列说法错误的是
| 化合物 |  |  |  |  |  |  |
 | 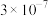 | 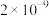 |  | 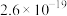 | 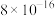 | 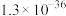 |
A.常温下,溶解度: |
B.向含同浓度的 和 和 混合溶液中滴加稀 混合溶液中滴加稀 溶液, 溶液, 先沉淀 先沉淀 |
C.向 悬浊液中加入 悬浊液中加入 溶液,无明显现象 溶液,无明显现象 |
D.反应 的平衡常数很小,反应几乎不进行 的平衡常数很小,反应几乎不进行 |
您最近一年使用:0次
名校
解题方法
8 . 氧化钴(Co2O3)在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石[主要成分为CoO(OH),CoCO3、Cu2(OH)2CO3和 SiO2,还有少量Fe、Mg、Ca的氧化物]为原料制备氧化钴(Co2O3)的工艺流程如图所示:

已知:常温下:Ksp(FeS)=6.3×10-18 Ksp(CuS)=6.3×10-36 Ksp(CaF2)=4.0×10-11 Ksp(MgF2)=9.0×10-11。
回答下列问题:
(1)写出“浸泡”过程中CoO(OH)与Na2SO3反应的离子方程式_______ 。
(2)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”过程的离子方程式_______ 。
(3)检验过程Ⅰ所得滤液中铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,_______ 。
(4)常温下,在过程Ⅱ中加入足量的NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时F-的浓度至少为_______ mol·L-1(溶液中离子浓度小于1×10-5 mol·L-1视为该离子沉淀完全)。
(5)过程Ⅲ中加入Na2CO3得到滤渣后又加入盐酸溶解,其目的是_______ 。

已知:常温下:Ksp(FeS)=6.3×10-18 Ksp(CuS)=6.3×10-36 Ksp(CaF2)=4.0×10-11 Ksp(MgF2)=9.0×10-11。
回答下列问题:
(1)写出“浸泡”过程中CoO(OH)与Na2SO3反应的离子方程式
(2)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”过程的离子方程式
(3)检验过程Ⅰ所得滤液中铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,
(4)常温下,在过程Ⅱ中加入足量的NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时F-的浓度至少为
(5)过程Ⅲ中加入Na2CO3得到滤渣后又加入盐酸溶解,其目的是
您最近一年使用:0次
名校
解题方法
9 . 下列实验操作和现象正确,且能得到对应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向 0.01mol/LKMnO4酸性溶液中滴加0.1mol/LH2C2O4溶液,充分振荡 | 溶液褪色 | H2C2O4体现氧化性 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液颜色逐渐褪去 | Na2CO3溶液中的水解平衡发生了移动 |
| C | 镀锡铁出现刮痕后浸入饱和食盐水中,一段时间后滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀 | 铁作原电池正极 |
| D | 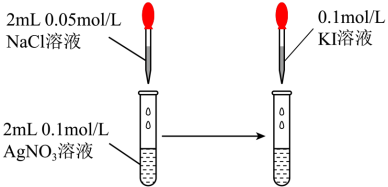 | 先产生白色沉淀,后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
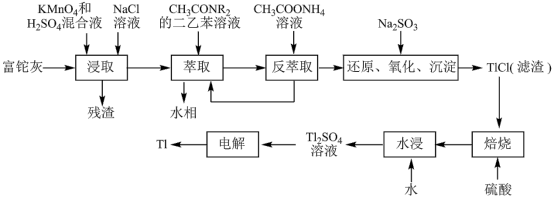
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
772次组卷
|
2卷引用:江西省八所重点中学2022届高三联考理科综合化学试题



