名校
解题方法
1 . 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定中和热 | 将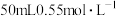 的NaOH溶液一次性迅速倒入盛 的NaOH溶液一次性迅速倒入盛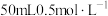 盐酸的烧杯中 盐酸的烧杯中 |
| B | 证明炭可与浓 反应生成 反应生成 | 向浓 中插入红热的炭,产生红棕色气体 中插入红热的炭,产生红棕色气体 |
| C | 证明AgCl的溶解度大于 | 向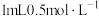 的 的 溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴 溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴 溶液产生黑色沉淀 溶液产生黑色沉淀 |
| D | 制取氨气并干燥 | 加热氯化铵和氢氧化钙的混合物,将产生的气体通过装有无水氯化钙的干燥管 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-30更新
|
270次组卷
|
2卷引用:江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题
名校
解题方法
2 . 下列实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 取两支试管,分别加入4mL 0.01mol/L KMnO4酸性溶液,然后向一支试管中加入0.1mol/L H2C2O4溶液2mL,向另一支试管中加入0.1mol/L H2C2O4溶液4mL,记录褪色时间。 | 可以证明H2C2O4浓度越大反应速率越快。 |
| B | 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀。 | 可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3 |
| C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。 | 证明了非金属性S>C |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。 | 可以证明Na2CO3溶液中存在水解平衡。 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列实验事实不能用平衡移动原理解释的是
| A.向pH=4的乙酸溶液稀释10倍后溶液pH<5 |
| B.相比较于常温,加热后的纯碱溶液去除厨房的油污的效果更好 |
C.对 平衡体系压缩容器后可使气体颜色变深 平衡体系压缩容器后可使气体颜色变深 |
| D.水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除 |
您最近一年使用:0次
4 . 常温下,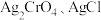 的
的 值分别为
值分别为 ,下列说法正确的是
,下列说法正确的是
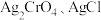 的
的 值分别为
值分别为 ,下列说法正确的是
,下列说法正确的是A.反应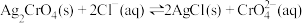 的平衡常数 的平衡常数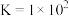 |
B.在食盐水中, 的溶解度及 的溶解度及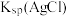 均比在蒸馏水中小 均比在蒸馏水中小 |
C.常温下, 饱和溶液中 饱和溶液中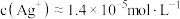 |
D.向饱和 中加入 中加入 溶液有沉淀生成, 溶液有沉淀生成, 减小 减小 |
您最近一年使用:0次
名校
解题方法
5 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
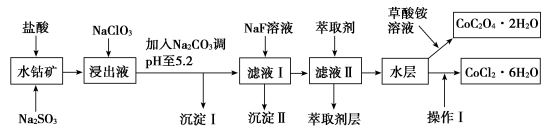
已知:①NaClO3不能氧化CoCl2
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3目的是_______ 。
(2)加入Na2CO3调pH至5.2,目的是_______ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为_______ 。
(3)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,_______ 、_______ 、过滤、洗涤、减压烘干等过程。
(4)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为_______ 。[已知:CoC2O4·2H2O的摩尔质量为183g·mol−1]

已知:①NaClO3不能氧化CoCl2
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)加入Na2CO3调pH至5.2,目的是
(3)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,
(4)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
您最近一年使用:0次
22-23高二上·北京西城·期中
6 . 下列实验方案不能达到相应目的的是
| 目的 | A.验证Fe是否被氧化 | B.研究浓度对FeCl3水解平衡的影响 |
| 实验方案 | 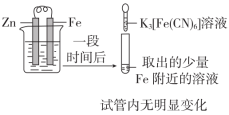 |  |
| 目的 | C.比较CH3COOH和H3BO3(硼酸,一元弱酸)酸性的强弱 | D.比较AgCl和AgI溶解度的大小 |
| 实验方案 |  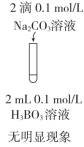 | 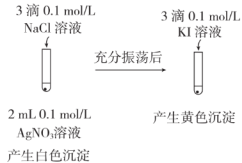 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 下列实验中,现象及结论都正确,且二者之间有因果的是
选项 | 实验操作 | 现象 | 结论 |
A | 用两支试管各取5 mL 0.1 mol/L酸性KMnO4溶液,分别加入2 mL 0.1 mol/L和0.2 mol/L H2C2O4溶液 | 两试管溶液均褪色,且加0.2 mol/LH2C2O4的试管中褪色更快 | 其他条件不变,H2C2O4浓度越大,化学反应速率越大 |
B | 比较CH3COOH和HClO的酸性强弱 | 用pH试纸分别测量物质的量浓度相等的CH3COONa比NaClO溶液的pH小 | CH3COOH比HClO的酸性强 |
C | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液 | 生成黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
D | 将10 mL 2 mol·L-1的KI溶液与1 mL 1 mol·L-1 FeCl3溶液混合充分反应后滴加KSCN溶液 | 溶液颜色变红 | KI与FeCl3的反应有可逆性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-16更新
|
225次组卷
|
2卷引用:江西省重点校2022-2023学年高三上学期第三次联考化学试题.
名校
8 . 下列反应的离子方程式书写正确的是
A.少量CO2通入漂白粉溶液中:CO2+H2O+ClO-=HClO+HCO |
B.用纯碱溶液转化水垢中的CaSO4:CO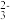 +CaSO4 +CaSO4 CaCO3+SO CaCO3+SO |
| C.磁性氧化铁溶于氢碘酸溶液:Fe3O4+8H+=Fe2++2Fe3++4H2O |
D.硫酸铜溶液通入H2S:Cu2++S2-=CuS |
您最近一年使用:0次
9 . 下列实验对应的离子方程式正确的是
A. 溶液刻蚀电路板: 溶液刻蚀电路板: |
B.明矾溶液与过量氨水混合: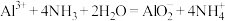 |
C.用二氧化硫的水溶液吸收溴蒸气: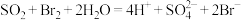 |
D.用碳酸钠溶液处理水垢中的硫酸钙: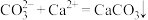 |
您最近一年使用:0次
2022-11-10更新
|
104次组卷
|
2卷引用:江西省赣州市十六县市二十校2022-2023学年高三上学期期中联考化学试题
10 . 科学家开发出的新型太阳能铜铟镓二硒(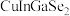 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含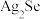 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
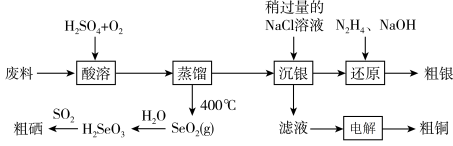
(1)NaOH的电子式为___________ 。
(2)下列事实能说明硫的非金属性比硒的强的是___________ (填标号)。
A.溶解度: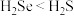
B.沸点: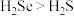
C.酸性: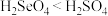
(3)“酸溶”时,能提高反应速率的措施有___________ (答1条即可)。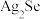 、
、 和
和 反应的化学方程式为
反应的化学方程式为___________ 。
(4)“电解”时,阳极生成的气体为___________ (填化学式),电解结束后,电解液的pH___________ (填“增大”、“减小”或“不变”)。
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下___________ LSO2参与反应。
(6)“沉银”时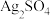 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
___________ 。[已知:常温下,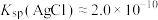 ,
,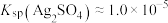 ]
]
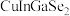 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含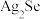 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
(1)NaOH的电子式为
(2)下列事实能说明硫的非金属性比硒的强的是
A.溶解度:
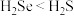
B.沸点:
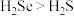
C.酸性:
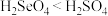
(3)“酸溶”时,能提高反应速率的措施有
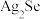 、
、 和
和 反应的化学方程式为
反应的化学方程式为(4)“电解”时,阳极生成的气体为
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下
(6)“沉银”时
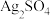 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
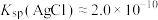 ,
,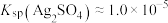 ]
]
您最近一年使用:0次



