名校
1 . 25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是


A.a点溶液满足:c(NH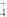 )>c(NH3·H2O)>c(Mg2+)>c(OH-) )>c(NH3·H2O)>c(Mg2+)>c(OH-) |
| B.b点溶液中无Mg(OH)2沉淀产生 |
C.c点溶液满足:2c(Mg2+)+c( )>c(Cl-) )>c(Cl-) |
| D.Ksp[Mg(OH)2]的数量级是10-12 |
您最近一年使用:0次
2022-10-27更新
|
427次组卷
|
3卷引用:江西省宜春市第一中学2022-2023学年高二上学期期末考试化学试题
2 . 锌锰废电池中的碳包主要含有 、MnOOH、
、MnOOH、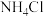 、
、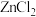 、炭粉,从中回收
、炭粉,从中回收 的流程如下:
的流程如下:
①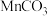 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
② 开始沉淀时pH为7.7,则:
开始沉淀时pH为7.7,则:
(1)为提高碳包溶解速率,可采取的措施有___________ (2点)
(2)第Ⅱ步在空气中烘炒的目的除了将MnOOH转化为 外,另一作用是
外,另一作用是___________
(3)“水浸”后需过滤,过滤用到的仪器有玻璃棒、___________ 和___________ 溶解一定量的 ,实际消耗的
,实际消耗的 比理论值高的原因是:
比理论值高的原因是:___________
(4)加入 溶液调节溶液
溶液调节溶液 ,充分反应直到不再有气泡产生;若溶液
,充分反应直到不再有气泡产生;若溶液 ,会导致产品中混有
,会导致产品中混有___________ (填化学式)。
(5)检测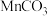 是否洗净的试剂是
是否洗净的试剂是___________
(6)高纯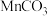 在空气中灼烧产生废气的化学方程式为
在空气中灼烧产生废气的化学方程式为___________
 、MnOOH、
、MnOOH、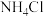 、
、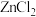 、炭粉,从中回收
、炭粉,从中回收 的流程如下:
的流程如下: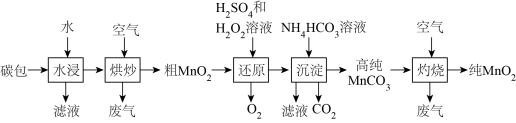
①
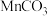 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;②
 开始沉淀时pH为7.7,则:
开始沉淀时pH为7.7,则:(1)为提高碳包溶解速率,可采取的措施有
(2)第Ⅱ步在空气中烘炒的目的除了将MnOOH转化为
 外,另一作用是
外,另一作用是(3)“水浸”后需过滤,过滤用到的仪器有玻璃棒、
 ,实际消耗的
,实际消耗的 比理论值高的原因是:
比理论值高的原因是:(4)加入
 溶液调节溶液
溶液调节溶液 ,充分反应直到不再有气泡产生;若溶液
,充分反应直到不再有气泡产生;若溶液 ,会导致产品中混有
,会导致产品中混有(5)检测
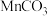 是否洗净的试剂是
是否洗净的试剂是(6)高纯
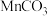 在空气中灼烧产生废气的化学方程式为
在空气中灼烧产生废气的化学方程式为
您最近一年使用:0次
2022-10-20更新
|
111次组卷
|
2卷引用:江西省南昌市第十九中学2022-2023学年高三上学期(11月)第四次月考化学试卷
名校
3 . 含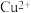 的废水常用
的废水常用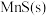 作沉淀剂,原理为
作沉淀剂,原理为 。一定温度下,下列有关该反应的推理正确的是
。一定温度下,下列有关该反应的推理正确的是
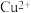 的废水常用
的废水常用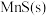 作沉淀剂,原理为
作沉淀剂,原理为 。一定温度下,下列有关该反应的推理正确的是
。一定温度下,下列有关该反应的推理正确的是A.该反应达到平衡时,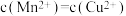 |
B.平衡体系中加入少量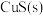 后, 后,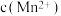 变小 变小 |
C.平衡体系中加入少量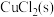 后, 后,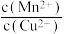 变大 变大 |
D.该反应平衡常数: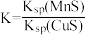 |
您最近一年使用:0次
2022-10-13更新
|
447次组卷
|
3卷引用:江西省宜春市宜丰中学2022-2023学年高三上学期11月期中考试化学试题
江西省宜春市宜丰中学2022-2023学年高三上学期11月期中考试化学试题浙江省10校联盟2022-2023学年高三上学期10月月考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题16-20)
4 . NiSO4•6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
(1)向滤液Ⅰ中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为___________ ,当c(Cu2+)≤1.0×10-5mol•L-1时,可认为Cu2+已沉淀完全,此时溶液中S2-的浓度不小于___________ 。(已知:Ksp(CuS)=6.3×10-36)
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2的目的是___________ 。
②调节滤液Ⅱ的pH,pH应控制在范围___________ 。
③检验滤液Ⅲ中杂质金属离子是否除尽的试剂是___________ 。
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___________ 。

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 2.2 | 3.2 |
| Ni2+ | 6.4 | 8.4 |
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2的目的是
②调节滤液Ⅱ的pH,pH应控制在范围
③检验滤液Ⅲ中杂质金属离子是否除尽的试剂是
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
2022-09-26更新
|
251次组卷
|
2卷引用:江西省丰城市第九中学2021-2022学年高二上学期期末考试化学试题
5 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
 | 向苯酚浊液中加入 溶液,溶液变澄清 溶液,溶液变澄清 | 酸性:苯酚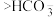 |
 | 无水乙醇与浓硫酸共热至 ,将产生的气体通入溴水中,溴水褪色 ,将产生的气体通入溴水中,溴水褪色 | 乙烯和溴水发生加成反应 |
 | 氯乙烷与 溶液共热后,滴加 溶液共热后,滴加 溶液,生成白色沉淀 溶液,生成白色沉淀 | 氯乙烷已发生水解 |
 | 在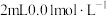 的 的 溶液中先滴入几滴 溶液中先滴入几滴  溶液有白色沉淀生成,再滴入 溶液有白色沉淀生成,再滴入  溶液,又出现黑色沉淀 溶液,又出现黑色沉淀 | 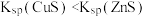 |
A. | B. | C. | D. |
您最近一年使用:0次
名校
解题方法
6 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向某溶液中滴加 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | 溶液中一定含 |
| B | 向 溶液中滴加稀硫酸酸化,再滴加 溶液中滴加稀硫酸酸化,再滴加 溶液,溶液变成血红色 溶液,溶液变成血红色 |  溶液已变质 溶液已变质 |
| C | 向 溶液中逐滴加入少量稀盐酸,无现象 溶液中逐滴加入少量稀盐酸,无现象 | 酸性: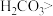 盐酸 盐酸 |
| D | 在足量 溶液中滴入几滴 溶液中滴入几滴 溶液有白色沉淀生成,再滴入 溶液有白色沉淀生成,再滴入 溶液,沉淀变为黑色 溶液,沉淀变为黑色 | 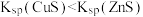 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-22更新
|
315次组卷
|
6卷引用:江西省吉安市第一中学2022-2023学年高三上学期11月期中考试化学试题
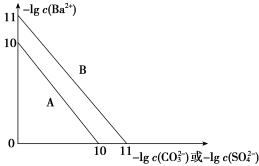
7 . 硫酸钡是一种比碳酸钡更难溶的物质。常温下-lg c(Ba2+)随-lg c(CO )或-lg c(SO
)或-lg c(SO )的变化趋势如图,下列说法正确的是
)的变化趋势如图,下列说法正确的是
 )或-lg c(SO
)或-lg c(SO )的变化趋势如图,下列说法正确的是
)的变化趋势如图,下列说法正确的是
| A.趋势线A表示硫酸钡 |
B.向100 mL含有CO 、SO 、SO 混合溶液中逐滴加入BaCl2溶液,SO 混合溶液中逐滴加入BaCl2溶液,SO 一定先沉淀 一定先沉淀 |
C.将碳酸钡和硫酸钡固体置于水中,此时溶液中的 =10 =10 |
| D.向碳酸钡悬浊液中加入饱和硫酸钠溶液,若碳酸钡转化成了硫酸钡,则可证明硫酸钡Ksp更小 |
您最近一年使用:0次
2022-08-16更新
|
598次组卷
|
7卷引用:江西省上饶市第一中学2022-2023学年高二上学期11月期中考试化学试题
江西省上饶市第一中学2022-2023学年高二上学期11月期中考试化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)重庆市第七中学校2021-2022学年高二上学期第二次月考化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)【定心卷】3.4.2 沉淀溶解平衡的应用随堂练习-人教版2023-2024学年选择性必修1湖南省衡阳市衡阳县第二中学2023-2024学年高二上学期期中考试化学试题黑龙江省牡丹江市第一高级中学2023-2024学年高二下学期开学初测试 化学试题
8 . 下列实验能达到预期目的是
| 选项 | 实验内容 | 实验目的 |
| A | 用pH试纸测试NaClO溶液pH | 证明HClO为弱酸 |
| B | 将SO2通入酸性KMnO4溶液中,溶液褪色 | 证明SO2具有漂白性 |
| C | 向1mL0.01mol/LKCl溶液中滴入2滴0.01mol/LAgNO3溶液,产生白色沉淀,再滴入2滴0.01mol/LKI溶液,又产生黄色沉淀 | 证明在相同温度下,Ksp(AgCl)>Ksp(AgI) |
| D | 某溶液中加入Ba(NO3)2,产生白色沉淀,再加入稀HCl,沉淀不溶解 | 证明原溶液中含SO42- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 无机研究开创绝不无“钴”的时代,草酸钴可用作指示剂和催化剂,CoCl2·6H2O可作为饲料营养强化剂。用某水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、 SiO2等)制取CoC2O4·2H2O及CoCl2·6H2O工艺流程如图所示:
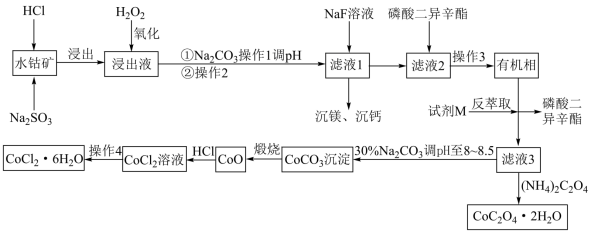
已知:①滤液1含有的阳离子主要有H+、Co2+、Mn2+、Ca2+、 Mg2+等;
②酸性条件下,H2O2不会氧化Co2+;
③该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“浸出”过程中,Co2O3参与反应的离子方程式为_______ 。
(2)“氧化”过程中涉及的反应离子方程式_______ 。
(3)“操作1”调pH的范围为_______ 。
(4)在实验室完成“操作3”需用到的玻璃仪器有_______ 。
(5)“操作4”洗涤过程中可以用工业酒精代替水,其优点是_______ 。
(6)由已知③可知,当Al3+完全沉淀(Al3+浓度为1.0 ×10-5mol·L-1 )时Fe3+的浓度为_______ 。
(7)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是_______(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20°C时的颜色及Ksp值如表:

已知:①滤液1含有的阳离子主要有H+、Co2+、Mn2+、Ca2+、 Mg2+等;
②酸性条件下,H2O2不会氧化Co2+;
③该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Co2+ | Mn2+ |
| 开始沉淀时 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀时 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
(1)“浸出”过程中,Co2O3参与反应的离子方程式为
(2)“氧化”过程中涉及的反应离子方程式
(3)“操作1”调pH的范围为
(4)在实验室完成“操作3”需用到的玻璃仪器有
(5)“操作4”洗涤过程中可以用工业酒精代替水,其优点是
(6)由已知③可知,当Al3+完全沉淀(Al3+浓度为1.0 ×10-5mol·L-1 )时Fe3+的浓度为
(7)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是_______(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20°C时的颜色及Ksp值如表:
| 化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
| A.KCl | B.K2CrO4 | C.KSCN | D.K2S |
您最近一年使用:0次
2022-07-07更新
|
512次组卷
|
2卷引用:江西省鹰潭市2022届高三下学期第一次模拟考试理科综合化学试题
10 . 下列事实不能用勒夏特列原理解释的是
A.石蕊(HZ)可发生电离:HZ(红色)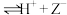 (蓝色),可用作酸碱指示剂 (蓝色),可用作酸碱指示剂 |
B.由 、 、 、HI(g)组成的平衡体系,加压后颜色变深 、HI(g)组成的平衡体系,加压后颜色变深 |
| C.黄绿色的氯水光照后颜色变浅 |
D.用 溶液将锅炉水垢中的 溶液将锅炉水垢中的 转化为 转化为 |
您最近一年使用:0次



