解题方法
1 . 下列有关实验操作和现象与结论对应关系正确的是
| 选项 | 操作和现象 | 结论 |
| A | 向 溶液中加入足量硝酸,将产生的气体通入 溶液中加入足量硝酸,将产生的气体通入 溶液中,产生白色沉淀 溶液中,产生白色沉淀 | 非金属性:N>C>Si |
| B | 向酸性 溶液中滴加丙烯醇( 溶液中滴加丙烯醇(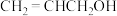 )并振荡,溶液褪色。 )并振荡,溶液褪色。 | 丙烯醇中含有醇羟基 |
| C | 向某待测液中滴加少量 ,再加入几滴KSCN溶液,溶液变为血红色 ,再加入几滴KSCN溶液,溶液变为血红色 | 待测液中一定含Fe3+ |
| D | 向10滴  溶液中,先滴入 溶液中,先滴入 的NaCl溶液,至不再有白色沉淀生成。再滴入 的NaCl溶液,至不再有白色沉淀生成。再滴入 的NaI溶液,白色沉淀转化为黄色沉淀。 的NaI溶液,白色沉淀转化为黄色沉淀。 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 按要求完成下列各空:
(1)25℃时,pH=2的盐酸 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则
_______ 。
(2)25℃时,在等体积的①pH=1的 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是_______ 。
(3) 相等的①
相等的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为_______ 。(填写序号)
(4)向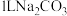 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中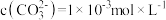 时,此时溶液中
时,此时溶液中
_______  。[已知
。[已知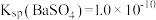 ,
,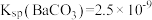 ]
]
(1)25℃时,pH=2的盐酸
 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则
(2)25℃时,在等体积的①pH=1的
 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是(3)
 相等的①
相等的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为(4)向
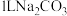 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中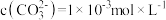 时,此时溶液中
时,此时溶液中
 。[已知
。[已知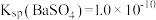 ,
,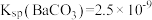 ]
]
您最近一年使用:0次
名校
3 . 利用含钴废料(主要成分是Co3O4,还含有Fe、Al、Cu等杂质)为原料回收复合氧化钴的流程如图所示:

(1)“碱溶”所得的溶液中含有的阴离子为___________ 。
(2)“氧化”:加热搅拌条件下加入NaClO3的作用是___________ 。
(3)“除铁”:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式___________ 。
(4)溶液e中加入(NH4)2C2O4使Co2+沉淀完全[c(Co2+)<10−5 mol∙L−1],控制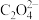 的浓度不小于
的浓度不小于___________ 。(已知:Ksp(CoC2O4)=6.3×10−8)
(5)称取2.940g CoC2O4,在空气中灼烧得1.740g复合氧化钴,则复合氧化钴的化学式为___________ 。

(1)“碱溶”所得的溶液中含有的阴离子为
(2)“氧化”:加热搅拌条件下加入NaClO3的作用是
(3)“除铁”:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式
(4)溶液e中加入(NH4)2C2O4使Co2+沉淀完全[c(Co2+)<10−5 mol∙L−1],控制
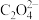 的浓度不小于
的浓度不小于(5)称取2.940g CoC2O4,在空气中灼烧得1.740g复合氧化钴,则复合氧化钴的化学式为
您最近一年使用:0次
4 . 化学与人类生产、生活、可持续发展密切相关。下列说法不正确的是
| A.乙烯的产量是衡量国家石油化工发展水平的重要标志 |
| B.用明矾代替二氧化氯处理生活污水,可提高杀菌消毒效果 |
| C.牙膏中添加氟化物用于预防龋齿 |
| D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
您最近一年使用:0次
2022-06-01更新
|
100次组卷
|
2卷引用:江西省丰城市第九中学2021-2022学年高二上学期期末考试化学试题
解题方法
5 . 下列实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将HI溶液加入Fe(NO3)3溶液中,充分反应后再加入CCl4混合振荡,静置 | 溶液分层, 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| B | 过量的铁粉和氯气反应,将反应后的固体溶于盐酸后,滴加KSCN溶液 | 溶液不显红色 | 过量铁与氯气反应的产物为FeCl2 |
| C | 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3溶液和CH3COONa溶液的pH | pH:Na2SO3>CH3COONa | H2SO3酸性弱于CH3COOH |
| D | 向2支装有等物质的量的AgCl、AgI的试管中分别滴加足量等体积等浓度的氨水 | AgCl溶解而AgI不溶解 | 相同温度下,Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 草酸亚铁晶体 FeC2O4·2H2O (其相对分子质量为180)可作为制备电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如图:


(1)仪器A的名称是_______ 。
(2)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示)_______ 。
(3)“洗涤”步骤的操作方法_______ 。
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量稀硫酸溶解,用0.05000mol·L-1酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。计算样品中FeC2O4·2H2O的纯度_______ (保留四位有效数字)
(5)实验中烘干后得到的草酸亚铁晶体FeC2O4·2H2O,称取5.40 g该样品在氩气气氛中进行热重法分析,得到剩余固体的质量随温度变化的曲线如图所示:

①上述FeC2O4·2H2O在氩气气氛进行热重法分析的原因是_______ 。
②分析图中数据,根据信息写出B对应的产物为_______ (填化学式)。
③600℃时剩余固体只有一种铁的氧化物, 且生成两种物质的量相等的气体。试写出B至C进程中所发生的化学反应方程式_______ 。


(1)仪器A的名称是
(2)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示)
(3)“洗涤”步骤的操作方法
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量稀硫酸溶解,用0.05000mol·L-1酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。计算样品中FeC2O4·2H2O的纯度
(5)实验中烘干后得到的草酸亚铁晶体FeC2O4·2H2O,称取5.40 g该样品在氩气气氛中进行热重法分析,得到剩余固体的质量随温度变化的曲线如图所示:

①上述FeC2O4·2H2O在氩气气氛进行热重法分析的原因是
②分析图中数据,根据信息写出B对应的产物为
③600℃时剩余固体只有一种铁的氧化物, 且生成两种物质的量相等的气体。试写出B至C进程中所发生的化学反应方程式
您最近一年使用:0次
解题方法
7 . 湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。Ag+与Cl-可结合生成多种络合物,在水溶液中存在如下平衡:AgCl43-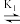 AgCl32-
AgCl32-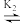 AgCl2-
AgCl2-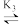 AgCl
AgCl Ag+。25℃时,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。下列说法错误的是
Ag+。25℃时,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。下列说法错误的是

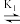 AgCl32-
AgCl32-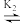 AgCl2-
AgCl2-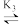 AgCl
AgCl Ag+。25℃时,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。下列说法错误的是
Ag+。25℃时,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。下列说法错误的是
| A.25℃时,Ksp(AgCl)=10-5.08 |
B.曲线c表示AgCl |
C.当c(Cl-)=10-2mol·L-1时,溶液中(AgCl )>c(Ag+)>c(AgCl )>c(Ag+)>c(AgCl ) ) |
| D.25℃时,平衡常数K2=10-0.2 |
您最近一年使用:0次
8 . 根据下列实验操作和现象,得到的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向盛 溶液的试管中滴加 溶液的试管中滴加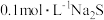 溶液至不再有白色沉淀产生,再向其中滴加 溶液至不再有白色沉淀产生,再向其中滴加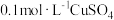 溶液,白色沉淀转化为黑色沉淀 溶液,白色沉淀转化为黑色沉淀 | 证明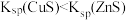 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO 水解引起的 水解引起的 |
C | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水,溶液未变蓝 | 淀粉完全水解 |
D | 压缩装有H2、I2(g)和HI混合气体(已平衡)的密闭容器,观察到气体颜色加深 | 无法证明平衡发生了移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 下列离子方程书写错误的是
| A.向 FeI2、FeBr2的混合溶液中通入少量氯气:2I-+Cl2= I2+2Cl- |
B.过量Ca(HCO3)2溶液与Ca(OH)2溶液反应:HCO + Ca2+ + OH- = CaCO3↓ + H2O + Ca2+ + OH- = CaCO3↓ + H2O |
C.向 NaHCO3溶液中加入氯化铁溶液:3HCO +Fe3+ =3CO2↑+Fe(OH)3↓ +Fe3+ =3CO2↑+Fe(OH)3↓ |
| D.AgCl悬浊液中滴入Na2S溶液:2Ag++S2- =Ag2S↓ |
您最近一年使用:0次
名校
解题方法
10 . 碲(Te)广泛用于太阳能、电子、医药等领域,对碲的综合回收利用尤为重要。工业上,从含碲化亚铜的废渣(主要成分Cu2Te,还有少量的Ag、Cu)中提取碲的流程如图:

回答下列问题:
(1)写出碲元素在元素周期表中的位置____ 。
(2)“酸浸”过程中生成TeOSO4的离子方程式为____ 。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明____ 。
(4)电解除铜时,铜、碲沉淀的关系如表。
①电解初始阶段阴极的电极反应式是____ 。
②最佳电解时间为30min,原因是____ 。
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式____ ,其中Te元素的回收率为____ (忽略溶液体积变化,结果用百分数表示,保留二位有效数字)。
(6)整个过程中可循环利用的物质为____ (填化学式)。

回答下列问题:
(1)写出碲元素在元素周期表中的位置
(2)“酸浸”过程中生成TeOSO4的离子方程式为
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明
(4)电解除铜时,铜、碲沉淀的关系如表。
| 电解时间(min) | 铜沉淀率 | 碲沉淀率 |
| 10 | 25% | 0.1% |
| 20 | 40% | 0.2% |
| 30 | 62% | 0.4% |
| 40 | 65% | 2.0% |
②最佳电解时间为30min,原因是
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式
(6)整个过程中可循环利用的物质为
您最近一年使用:0次
2022-05-05更新
|
668次组卷
|
3卷引用:江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题
江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题



