1 . 含锌催化剂(主要为ZnO、同时含有少量Fe、Cu、Pb等氧化物)用于合成氨工业和有机合成工业。为充分利用资源,通过如下工艺流程回收锌并制备纳米氧化锌。
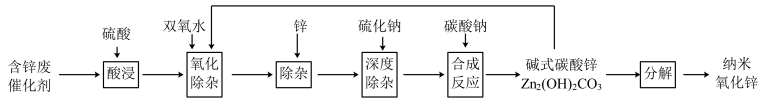
(1)90℃酸浸中,硫酸质量分数控制在30%左右,原因是___________ 。
(2)氧化除杂阶段主要是除去铁,氧化时发生的离子方程式是_______ 。调节pH发生的离子方程式为________ 。
(3)加入锌除去的杂质离子是________ ,深度除杂的目的是__________ 。
(4)由碱式碳酸锌分解得到纳米氧化锌的方法是__________ 。
(5)酸浸中,硫酸的量是理论用量的90%,硫酸不能过量的主要原因是___________ 。

(1)90℃酸浸中,硫酸质量分数控制在30%左右,原因是
(2)氧化除杂阶段主要是除去铁,氧化时发生的离子方程式是
(3)加入锌除去的杂质离子是
(4)由碱式碳酸锌分解得到纳米氧化锌的方法是
(5)酸浸中,硫酸的量是理论用量的90%,硫酸不能过量的主要原因是
您最近一年使用:0次
名校
2 . 下列过程中的化学反应,相应的离子方程式正确的是
A.用NaOH溶液吸收NO2:2OH-+2NO2=2 +H2O +H2O |
B.用过量NaOH溶液脱除烟气中的SO2:SO2+OH-= |
C.NaHCO3溶液中加过量Ba(OH)2溶液:2 +Ba2++2OH-=BaCO3↓+ +Ba2++2OH-=BaCO3↓+ +2H2O +2H2O |
D.向盐碱地中(主要含碳酸钠)施放硫酸钙,降低其碱性: +CaSO4=CaCO3+ +CaSO4=CaCO3+ |
您最近一年使用:0次
2022-03-06更新
|
1111次组卷
|
5卷引用:江西省南昌市 2022届高三第一次模拟考试理综化学试题
江西省南昌市 2022届高三第一次模拟考试理综化学试题北京市八一学校2021-2022学年高三下学期二模前阶段性测试化学试题(已下线)专题03离子反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题03离子反应-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题03离子反应-五年(2018~2022)高考真题汇编(全国卷)
3 . 某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3和PbI2在水溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO )或-lgc(I-)的关系如图所示。下列说法不正确的是
)或-lgc(I-)的关系如图所示。下列说法不正确的是

 )或-lgc(I-)的关系如图所示。下列说法不正确的是
)或-lgc(I-)的关系如图所示。下列说法不正确的是
| A.室温下,Ksp(PbI2)的数量级为10-8 |
| B.P点对应的是PbI2饱和溶液 |
C.L2对应的是-lgc(Pb2+)与-lgc(CO )的关系变化 )的关系变化 |
| D.向浓度相同的Na2CO3、NaI混合溶液中逐滴加入Pb(NO3)2溶液,先产生白色沉淀 |
您最近一年使用:0次
4 . 下列实验操作、现象、结论正确的是
| 操作及现象 | 结论 | |
| A | 向Al2(SO4)3溶液中滴加Na2S溶液,产生白色沉淀 | 白色沉淀成分是Al2S3 |
| B | 将50mL 0.55mol/L的NaOH溶液缓慢倒入盛有50mL 0.50mol/L的HCl溶液的烧杯中 | 测定中和热 |
| C | 向盛有2mL 0.1mol/L ZnSO4溶液的试管中加入2mL 1mol/L Na2S溶液,再加入0.1mol/L CuSO4溶液,最终得到黑色沉淀 | CuS的溶解度比ZnS小 |
| D | 向盛有0.01mol/L CH3COONa溶液的试管中滴加几滴酚酞试液,溶液变红,加热,颜色变深 | 溶液中存在水解平衡CH3COO-+H2O CH3COOH+OH-,且为吸热反应 CH3COOH+OH-,且为吸热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 锂被誉为“高能金属”,废旧锂离子电池的正极材料主要含有LiCoO2及少量Al、Fe等,处理该废料的一种工艺流程如图所示:
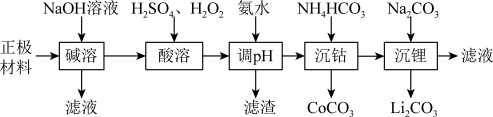
已知:①LiCoO2难溶于水:
②相关金属离子形成氢氧化物沉淀的pH值如下表所示:
③碳酸锂的溶解度(S)如下表所示:
回答下列问题:
(1)写出“碱溶”时发生主要反应的离子方程式:_______ 。
(2)为提高“酸溶”的浸出速率,可采取的措施有_______ (任写一种)。
(3)“酸溶”时,LiCoO2发生的主要反应的离子方程式为_______ ;若用浓盐酸代替H2SO4和H2O2的混合液,缺点是_______ 。
(4)用氨水调节pH的范围为_______ 。
(5)沉锂过程的操作方法:加入略过量的碳酸钠后,搅拌、_______ 、_______ 、洗涤、干燥。

已知:①LiCoO2难溶于水:
②相关金属离子形成氢氧化物沉淀的pH值如下表所示:
| Al3+ | Fe3+ | Fe2+ | Co2+ | |
| 开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.0 |
③碳酸锂的溶解度(S)如下表所示:
| T℃ | 20 | 80 | 100 |
| S(Li2CO3)/g | 1.33 | 0.85 | 0.72 |
回答下列问题:
(1)写出“碱溶”时发生主要反应的离子方程式:
(2)为提高“酸溶”的浸出速率,可采取的措施有
(3)“酸溶”时,LiCoO2发生的主要反应的离子方程式为
(4)用氨水调节pH的范围为
(5)沉锂过程的操作方法:加入略过量的碳酸钠后,搅拌、
您最近一年使用:0次
2022-02-16更新
|
123次组卷
|
2卷引用:江西省赣州市赣县第三中学2021-2022学年高二下学期3月月考化学试题
6 . 常温下,向10mL浓度均为0.1mol/LFeCl3和CuCl2的溶液中逐滴加入0.1mol/L的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知Ksp[Fe(OH)3]=10-39Ksp=[Cu(OH)2]=10-20,则下列说法正确的是


| A.将0.1molFe(OH)3和0.1molCu(OH)2溶于1L水中,所得溶液c(Fe3+)>c(Cu2+) |
| B.当溶液的pH=6时,溶液中c(Cu2+)>c(H+)>c(Fe3+) |
| C.沉淀的成份:OA段有产生Fe(OH)3、Cu(OH)2沉淀,AB段只产生Cu(OH)2沉淀 |
| D.水的电离程度:C>B>A |
您最近一年使用:0次
解题方法
7 . 实验室用绿矾(FeSO4·7H2O,M=278g/mol)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe,M=204g/mol]。
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验步骤:
1.配制220mL0.800mol·L-1FeSO4溶液,取200mL于烧杯中,并向其中缓慢加入200mL2.000mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀FeCO3。
ii.实验装置如图所示(夹持和加热仪器略去),将i得到的沉淀和甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。

iii.反应结束后过滤,将滤液进行蒸发浓缩,加入无水乙醇,过滤、洗涤并干燥,得到产品24.480g。
回答下列问题:
(1)配制FeSO4溶液,用到的玻璃仪器除量筒、烧杯、胶头滴管之外,还必须使用的仪器有________ 。需要用电子天平(精确到0.001g)称量绿矾________ g。
(2)实验i中生成沉淀的化学方程式为________ ,洗涤沉淀的操作是________ 。
(3)A中反应的离子方程式为________ ,表明C中空气被排尽的实验现象是________ 。
(4)C装置中加入柠檬酸溶液的作用是防止Fe2+被氧化和________ 。
(5)步骤ⅲ中加入无水乙醇的作用是________ 。
(6)该实验产率为________ 。
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验步骤:
1.配制220mL0.800mol·L-1FeSO4溶液,取200mL于烧杯中,并向其中缓慢加入200mL2.000mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀FeCO3。
ii.实验装置如图所示(夹持和加热仪器略去),将i得到的沉淀和甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。

iii.反应结束后过滤,将滤液进行蒸发浓缩,加入无水乙醇,过滤、洗涤并干燥,得到产品24.480g。
回答下列问题:
(1)配制FeSO4溶液,用到的玻璃仪器除量筒、烧杯、胶头滴管之外,还必须使用的仪器有
(2)实验i中生成沉淀的化学方程式为
(3)A中反应的离子方程式为
(4)C装置中加入柠檬酸溶液的作用是防止Fe2+被氧化和
(5)步骤ⅲ中加入无水乙醇的作用是
(6)该实验产率为
您最近一年使用:0次
解题方法
8 . 新一代脱硝催化剂(SCR)(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
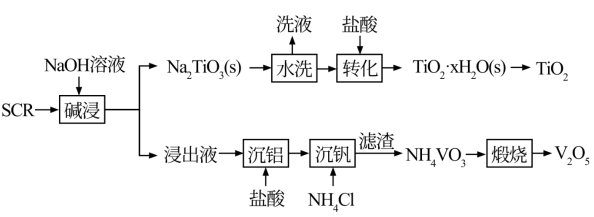
已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有___________ (写出一种措施即可)。
(2)“沉铝”过程中得到的沉淀主要成分是___________ (填化学式)
(3)“转化”时的离子方程式为___________ 。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是___________ 。
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为___________ (溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全)。
(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:___________ 。
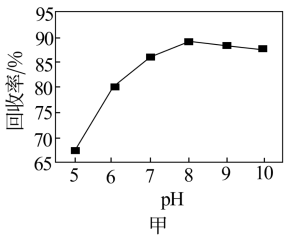
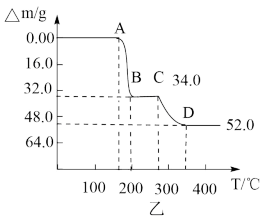
(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为___________

已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有
(2)“沉铝”过程中得到的沉淀主要成分是
(3)“转化”时的离子方程式为
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:

(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为

您最近一年使用:0次
9 . 根据下列实验操作和现象所得结论正确的是
| 实验操作和现象 | 实验结论 | |
| A. | 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 | HNO2电离出的H+的能力比CH3COOH的强 |
| B. | 向麦芽糖溶液中加入稀硫酸并加热,再调节pH呈酸性,再加入银氨溶液,水浴加热,有银镜产生 | 麦芽糖发生水解 |
| C. | 将镀层破损的镀锌铁皮浸泡在食盐水中,一段时间后加入K3[(CN)6]溶液,无明显现象 | 没有发生原电池反应 |
| D. | 向2ml0.1mol。L-1NaOH溶液中加入2 ml0.1mol·L-1MgCl2溶液,产生白色沉淀,再加入几滴0.1mol·L-1FeCl3溶液,产生红褐色沉淀 | Mg(OH)2沉淀可以转化为Fe (OH)3沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 某温度时, 在水中的沉淀溶解平衡曲线如图所示。已知:
在水中的沉淀溶解平衡曲线如图所示。已知: ,
,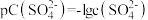 。下列说法正确的是
。下列说法正确的是

 在水中的沉淀溶解平衡曲线如图所示。已知:
在水中的沉淀溶解平衡曲线如图所示。已知: ,
,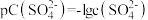 。下列说法正确的是
。下列说法正确的是
A.该温度下,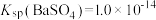 |
B.a点的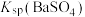 小于c点的 小于c点的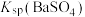 |
C.加入 可以使溶液由c点变到a点 可以使溶液由c点变到a点 |
D.b、d两点代表的溶液中 与 与 乘积d点的大 乘积d点的大 |
您最近一年使用:0次
2022-01-23更新
|
138次组卷
|
2卷引用:江西省赣州市第一中学2021-2022学年高二下学期中期质量检测(1)化学试题



