9-10高二下·辽宁大连·期末
名校
1 . 以下对核外电子运动状态的描述正确的是( )
| A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 |
| B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 |
| C.能层序数越大,s原子轨道的半径越大 |
| D.在同一能级上运动的电子,其运动状态肯定相同 |
您最近一年使用:0次
2018-12-19更新
|
303次组卷
|
15卷引用:云南省玉溪市景东一中2018-2019学年高二6月份考试化学试题
云南省玉溪市景东一中2018-2019学年高二6月份考试化学试题(已下线)09-10年辽宁大连23中高二下学期期末考试化学卷(已下线)2011-2012学年新疆喀什二中高一下学期第一次月考检测化学试卷(已下线)2011-2012学年陕西省宝鸡中学高二下学期期末考试化学试卷2015-2016学年内蒙古赤峰二中高二下4月月考化学试卷人教版2017-2018学年高二化学选修三同步训练:1.1 原子结构(第2课时)山西省大同市第三中学2017-2018学年高二下学期4月月考化学试题贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题云南省昭通市永善县第二中学2019—2020学年高二上学期期末考试化学试题吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题吉林省长春市榆树高级中学2020-2021学年高二下学期期中考试化学试题云南省瑞丽市第一民族中学2021-2022学年高一上学期期末考试 化学试题云南省瑞丽市第一民族中学2021-2022学年高二上学期期末考试化学试题
名校
2 . Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__ 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__ (填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________ .
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):
①H、O、N三种元素的电负性从大到小的顺序____ 。
②乙二胺分子中N原子成键时采取的杂化类型是__ 。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__ 。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):
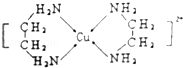
①H、O、N三种元素的电负性从大到小的顺序
②乙二胺分子中N原子成键时采取的杂化类型是
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是
您最近一年使用:0次
2018-12-17更新
|
284次组卷
|
5卷引用:云南省普洱市景东县第一中学2018-2019学年高二上学期期末考试化学试题
名校
解题方法
3 . A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为nsnnp2n。E的原子序数为29。
(1)A,B,C的第一电离能由小到大的顺序为________ (用元素符号表示)。
(2)X是含有________ 键(填“非极性”或“极性”,下同)的________ 分子。
(3)A的一种氢化物的相对分子质量为26,其分子中的σ键与π键的键数之比为________ 。
(4)Y分子的空间构型为__________ ,其中心原子采取________ 杂化。
(5)一种由B,C组成的化合物与AC2互为等电子体,其化学式为________ 。
(6)Y是一种易液化的气体,请简述其易液化的原因_________ 。
(7)写出E2+的电子排布式___________________ ,并写出E2+在Z中通入足量Y得到深蓝色溶液的离子反应方程式_______ 。
(1)A,B,C的第一电离能由小到大的顺序为
(2)X是含有
(3)A的一种氢化物的相对分子质量为26,其分子中的σ键与π键的键数之比为
(4)Y分子的空间构型为
(5)一种由B,C组成的化合物与AC2互为等电子体,其化学式为
(6)Y是一种易液化的气体,请简述其易液化的原因
(7)写出E2+的电子排布式
您最近一年使用:0次
2018-10-31更新
|
296次组卷
|
4卷引用:云南省景东一中2018-2019学年高二下学期开学考试化学试题
名校
4 . 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子层排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第ⅠA族元素。回答下列问题:
(1)基态G原子的价电子排布式为____________ ,写出第三周期基态原子未成对电子数与G相同且电负性最大的元素是________ (填元素名称)。GQ受热分解生成G2Q和Q2,请从G的原子结构来说明GQ受热易分解的原因:___________________________ 。
(2)Z、Q、M三种元素的第一电离能从大到小的顺序为____________ (用元素符号表示)。
(3)X与Q形成的化合物的化学式为________ 。
(4)Z、M、E所形成的简单离子的半径由大到小顺序为____________ (用离子符号表示)。
(5)X、Y、Z、Q的电负性由大到小的顺序为____________ (用元素符号表示)。
(1)基态G原子的价电子排布式为
(2)Z、Q、M三种元素的第一电离能从大到小的顺序为
(3)X与Q形成的化合物的化学式为
(4)Z、M、E所形成的简单离子的半径由大到小顺序为
(5)X、Y、Z、Q的电负性由大到小的顺序为
您最近一年使用:0次
2018-04-24更新
|
388次组卷
|
11卷引用:云南省普洱市普洱第二中学2019—2020学年高二上学期期末考试化学试题
云南省普洱市普洱第二中学2019—2020学年高二上学期期末考试化学试题宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题云南省玉溪市华宁二中2018-2019学年9月份考试高二化学试题四川省遂宁二中2018-2019学年高二上学期半期考试化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省陇川县第一中学2019-2020学年高二上学期期末考试化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题云南省昭通市大关县第二中学2019-2020学年高二上学期期末考试化学试题贵州省罗甸县第一中学2019-2020学年高二上学期期末考试化学试题安徽省安庆市第一中学2022-2023学年高二下学期第一次月考化学试题安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题
名校
解题方法
5 . 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O==NaN3+NaOH+NH3,3NaNH2+NaNO3==NaN3+3NaOH+NH3↑。
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是________ ,第一电离能最小的元素是_______ 。
(2)基态氮原子的L层电子排布图为_________________ 。
(3)与N3-互为等电子体的分子为_________ (写出一种)。依据价层电子对互斥理论,NO3-的空间构型是______________ ,其中心原子杂化类型是__________ 。
(4)叠氮化钠中不含有 的化学键类型有_____________ 。
A.离子键 B.极性共价键 C.σ键 D.π键
(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是____________________________________________________________________________________ 。
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是
(2)基态氮原子的L层电子排布图为
(3)与N3-互为等电子体的分子为
(4)叠氮化钠中
A.离子键 B.极性共价键 C.σ键 D.π键
(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是
您最近一年使用:0次
2018-02-25更新
|
407次组卷
|
4卷引用:云南省普洱市2017-2018学年高二下学期期末考试理科综合化学试题
名校
解题方法
6 . 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________ 。
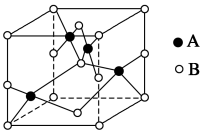
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________ 。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________ 键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____ 。与NH3分子互为等电子体的一种微粒是________ 。
(4)CuO的熔点比CuCl的熔点____ (填“高”或“低”)。
(1)写出基态Cu+的核外电子排布式
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过
(4)CuO的熔点比CuCl的熔点
您最近一年使用:0次
2018-02-11更新
|
206次组卷
|
7卷引用:云南省普洱市景东县第一中学2018-2019学年高二上学期期末考试化学试题
名校
解题方法
7 . 下列关于能层与能级的说法中正确的是
| A.同一原子中,符号相同的能级,其上电子能量不一定相同 |
| B.任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数 |
| C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 |
| D.多电子原子中,每个能层上电子的能量一定不同 |
您最近一年使用:0次
2018-02-11更新
|
548次组卷
|
16卷引用:云南省景谷一中2018-2019学年高二下学期第一次月考化学试题
云南省景谷一中2018-2019学年高二下学期第一次月考化学试题宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1四川省遂宁二中2018-2019学年高二上学期半期考试化学试题吉林省汪清县第六中学2018-2019学年高二6月月考化学试题新疆喀什巴楚县第一中学2019-2020学年高二下学期期中考试化学(B卷)试题新疆喀什巴楚县第一中学2019-2020学年高二下学期期中考试化学(A卷)试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第1节 原子结构模型(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题(已下线)1.1.1 能层和能级 基态和激发态 原子光谱-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期4月月考化学试题吉林省长春市综合实验中学2021-2022学年高二上学期期末考试化学试题 广东省茂名化州市第三中学2021-2022学年高二下学期3月月考化学试题(已下线)第1讲 原子结构 核外电子排布1.1原子结构模型(课后)-鲁科版选择性必修2云南省大理州实验中学2021-2022学年高二下学期化学期中考试题
名校
8 . 基态硅原子的最外能层的各能级中,电子排布的方式正确的是( )
A. | B. |
C. | D.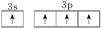 |
您最近一年使用:0次
2018-01-18更新
|
126次组卷
|
9卷引用:云南省景谷一中2018-2019学年高二下学期第一次月考化学试题
云南省景谷一中2018-2019学年高二下学期第一次月考化学试题宁夏育才中学2017-2018学年高二上学期期末考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题云南省河口县一中2018-2019学年高二上学期期中考试化学试题吉林省汪清县第六中学2018-2019学年高二下学期期中考试化学试题贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题云南省施甸县第三中学2019-2020学年高二12月月考化学试题海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题
2016高二·全国·课后作业
名校
9 . 能够证明核外电子是分层排布的事实是
| A.电负性 | B.电离能 |
| C.非金属性 | D.电子绕核运动 |
您最近一年使用:0次
2017-11-27更新
|
517次组卷
|
7卷引用:云南省普洱市孟连县一中2018-2019学年高二下学期期末考试化学试题
云南省普洱市孟连县一中2018-2019学年高二下学期期末考试化学试题云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题(已下线)同步君 选修3 第一章 第二节 元素周期律高中化学人教版 选修三 第1章 原子结构与性质 元素周期律云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
14-15高二上·山西朔州·阶段练习
名校
解题方法
10 . 具有如下电子层结构的原子,其相应元素一定属于同一主族的是( )
| A.3p能级上有2个未成对电子的原子和4p能级上有2个未成对电子的原子 |
| B.3p能级上只有1个空轨道的原子和4p能级上只有1个空轨道的原子 |
| C.最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子 |
| D.最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 |
您最近一年使用:0次
2017-11-27更新
|
500次组卷
|
8卷引用:云南省景东一中2018-2019学年高二下学期开学考试化学试题
云南省景东一中2018-2019学年高二下学期开学考试化学试题(已下线)2013-2014学年山西省朔州市应县一中高二上学期第四次月考化学试卷(已下线)同步君 选修3 第一章 第二节 原子结构与元素周期表高中化学人教版 选修三 第1章 原子结构与性质 原子结构与元素周期表云南省禄丰县一中2019-2020学年高二12月月考化学试题云南省临沧市双江县第一中学2019-2020学年高二上学期12月月考化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题福建省福州第一中学2023-2024学年高二下学期4月期中考试化学试题



