解题方法
1 . 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。已知铜的配合物A结构如图。请回答下列问题:

(1)基态二价铜离子的电子排布式为___ ,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释___ 。
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是___ ;N2O与CO2互为等电子体,则N2O的电子式为___ 。
(3)铜与(SCN)2反应生成Cu(SCN)2,lmol(SCN)2中含有π键的数目为___ (用NA表示),HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N≡C≡S)的原因是___ 。
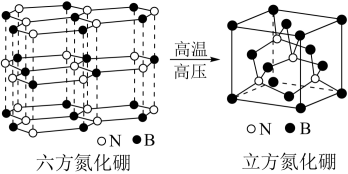
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___ 。
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为___ 。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为361.5pm,立方氮化硼的密度是___ g·cm-3(只列算式,NA为阿伏加德罗常数的值)。

(1)基态二价铜离子的电子排布式为
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是
(3)铜与(SCN)2反应生成Cu(SCN)2,lmol(SCN)2中含有π键的数目为
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为

您最近一年使用:0次
2021-01-07更新
|
457次组卷
|
2卷引用:云南省玉溪市普通高中2021届高三上学期第一次教学质量检测化学试题
名校
解题方法
2 . I.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_________ 。
(2)Li及其周期表中相邻元素的第一电离能(I1),I1(Li)> I1(Na),原因是_________ 。
Ⅱ.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(3)NH3BH3分子中,N—B化学键称为________ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气: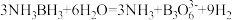 ,
,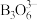 的结构如图所示:
的结构如图所示:
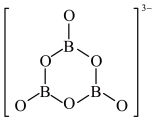
在该反应中,B原子的杂化轨道类型由________ 变为__________ 。
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________ 。
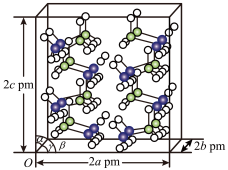
(5)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=______ g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为
(2)Li及其周期表中相邻元素的第一电离能(I1),I1(Li)> I1(Na),原因是
Ⅱ.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(3)NH3BH3分子中,N—B化学键称为
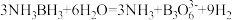 ,
, 的结构如图所示:
的结构如图所示:
在该反应中,B原子的杂化轨道类型由
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(5)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=

您最近一年使用:0次
2020-11-02更新
|
393次组卷
|
2卷引用:云南省红河州2021届高中毕业生第一次复习统一检测理综化学试题
3 . 亚铁氰化钾(K4[Fe(CN)6])是重要的化工原料和食品添加剂,又称黄血盐。黄血盐溶液与稀硫酸加热时发生反应:K4[Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
(1)写出基态Fe2+的核外电子排布式______ 。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______ 和______ 。:1mol K4[Fe(CN)6]中含有σ键的数目为_____ NA。
(3)(NH4)2SO4中N原子的杂化方式为______ ;N和O相比,第一电离能更大的是______ ,电负性更大的是______ 。
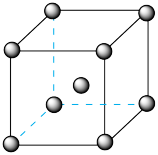
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为______ ,钠、钾相比,熔点更高的是______ ,原因是______ 。已知铁的原子半径为r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁的密度为______ g·cm-3。
 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:(1)写出基态Fe2+的核外电子排布式
(2)K4[Fe(CN)6]中的作用力除共价键外,还有
(3)(NH4)2SO4中N原子的杂化方式为
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为

您最近一年使用:0次
名校
解题方法
4 . 近日,某科研团队成功合成了Ni—Fe双原子催化剂(Ni/Fe—C—N),并应用于高效催化CO2还原。回答下列问题:
(1)基态铁原子的价电子轨道排布图为__ 。铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+__ Fe3+(填“>”或“<”),原因是__ 。
(2)C、N、O三种元素的第一电离能由大到小的顺序为__ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和为18,则n=___ ;该化合物易溶于苯及四氯化碳等有机溶剂,原因是___ 。
(4)二茂铁的结构为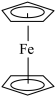 ,由Fe2+和
,由Fe2+和 (环戊二烯基负离子)构成。一个
(环戊二烯基负离子)构成。一个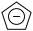 中σ键总数为
中σ键总数为__ ,C原子的杂化轨道类型为__ 。
(5)某C、Fe合金的晶胞结构如图所示:
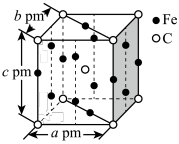
该合金的化学式为__ ,若该晶体的晶胞参数为apm、bpm、cpm,α=β=γ=90o,密度为ρg·cm-3,则NA为__ (写出计算式即可)。
(1)基态铁原子的价电子轨道排布图为
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和为18,则n=
(4)二茂铁的结构为
 ,由Fe2+和
,由Fe2+和 (环戊二烯基负离子)构成。一个
(环戊二烯基负离子)构成。一个 中σ键总数为
中σ键总数为(5)某C、Fe合金的晶胞结构如图所示:

该合金的化学式为
您最近一年使用:0次
2020-06-18更新
|
378次组卷
|
2卷引用:云南省昆明市2020届高三“三诊一模”高考模拟考试(三模)理综化学试题
解题方法
5 .  、
、 、
、 、
、 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:
(1)钴原子的基态电子排布式为_______________________ 。
(2) 有
有________ 几种不同的运动状态的电子, 比
比 更稳定的原因是
更稳定的原因是_________ 。
(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为_________ (用元素符号表示)。
(4) 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体 属于
属于______ 晶体。 的空间构型为
的空间构型为_____ 。
(5) 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。 分子中S的杂化方式为
分子中S的杂化方式为______ 。每个 分子中含有的孤电子对的数目为
分子中含有的孤电子对的数目为_________ 。

(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为____________ 。若该晶胞的边长为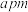 ,阿伏加 德罗常数值为
,阿伏加 德罗常数值为 ,则该氧化物的密度为
,则该氧化物的密度为_________ 
 、
、 、
、 、
、 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:(1)钴原子的基态电子排布式为
(2)
 有
有 比
比 更稳定的原因是
更稳定的原因是(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为
(4)
 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体 属于
属于 的空间构型为
的空间构型为(5)
 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。 分子中S的杂化方式为
分子中S的杂化方式为 分子中含有的孤电子对的数目为
分子中含有的孤电子对的数目为
(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为
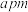 ,阿伏加 德罗常数值为
,阿伏加 德罗常数值为 ,则该氧化物的密度为
,则该氧化物的密度为
您最近一年使用:0次
6 . 自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________ ,砷属于________ 区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为___________________________ 。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如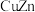 ,
,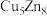 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能________ (填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是________ ,与Ti形成配位键的配体是________ , 该配合物中含有
该配合物中含有 键的数目为
键的数目为________ 。
(5) 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为:________ ;与 互为等电子体的分子有:
互为等电子体的分子有:___________________ (填分子式)。
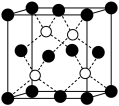
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________  (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
(1)请写出Fe的基态原子核外电子排布式
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |  |  |  |  |
| A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为
(3)锌化铜是一种金属互化物,其化学式有多种形式,如
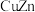 ,
,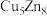 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能(4)用锌还原
 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是 该配合物中含有
该配合物中含有 键的数目为
键的数目为(5)
 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为: 互为等电子体的分子有:
互为等电子体的分子有:(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示
 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ= (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
您最近一年使用:0次
解题方法
7 . 氢氧化镍在乙醇的悬浊液中可发生反应生成单质镍的配合物:Ni(OH)2+5CH3NC=(CH3NC)4Ni+CH3NCO+H2O。
(1)基态镍原子的未成对电子数为__ ,钯(Pd)与镍位于同一族,且Pd是Ni的下一周期元素,基态钯原子的未成对电子数为0,基态钯原子的外围电子排布式为___ 。
(2)CH3NCO中四种元素的第一电离能由大到小的顺序为___ 。CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是___ 。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。与COCl2互为等电子体的一种阴离子为___ 。
(4)如图,在镍的催化作用下,甲基呋哺与氨在高温下反应得到甲基吡咯。甲基吡咯的熔、沸点高于甲基呋喃的原因是_____________ 。

(5)(CH3NC)4Ni可作为储氢材料,某种镁铝合金也可作为储氢材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为___ ,该晶体的密度为__ g·cm-3(阿伏加 德罗常数的数值用NA表示)。

(1)基态镍原子的未成对电子数为
(2)CH3NCO中四种元素的第一电离能由大到小的顺序为
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。与COCl2互为等电子体的一种阴离子为
(4)如图,在镍的催化作用下,甲基呋哺与氨在高温下反应得到甲基吡咯。甲基吡咯的熔、沸点高于甲基呋喃的原因是

(5)(CH3NC)4Ni可作为储氢材料,某种镁铝合金也可作为储氢材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为

您最近一年使用:0次
8 . VA族元素氮、磷、砷(As)、锑(Sb)、铋(Bi)的单质及其化合物在科研和生产中有许多重要用途。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。铋的价电子排布式为_______ 。
(2)第三周期元素中第一电离能大于磷的元素有_______ (填元素符号)。
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是_______ (填“顺式”或“反式”)。

(4)氨硼烷(BH3▪NH3)是一种储氢材料,与乙烷互为等电子体,熔点为104℃。氨硼烷晶体中各种微粒间的作用力涉及________ (填标号)。
A.范德华力 B.离子键 C.配位键 D.金属键
(5)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,可杀死各种草本植物,其阴离子的立体构型为___ 。
(6)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H44+,其结构式为_______ ,其中N原子的杂化方式为________ 。
(7)镧、铁、锑三种元素组成的一种固体能实现热电效应。该固体晶胞结构如图l所示,晶胞参数为a nm,Fe原子填在6个Sb原子形成的正八面体空隙中,晶胞6个表面的结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图l中原子甲的坐标为(0,0,0),原子乙的坐标为( ,
, ,0),则原子丙的坐标为
,0),则原子丙的坐标为________ 。
②设阿伏加 德罗常数的值为NA,则该固体的密度ρ=__ g·cm-3(列出计算式即可)。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。铋的价电子排布式为
(2)第三周期元素中第一电离能大于磷的元素有
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是

(4)氨硼烷(BH3▪NH3)是一种储氢材料,与乙烷互为等电子体,熔点为104℃。氨硼烷晶体中各种微粒间的作用力涉及
A.范德华力 B.离子键 C.配位键 D.金属键
(5)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,可杀死各种草本植物,其阴离子的立体构型为
(6)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H44+,其结构式为
(7)镧、铁、锑三种元素组成的一种固体能实现热电效应。该固体晶胞结构如图l所示,晶胞参数为a nm,Fe原子填在6个Sb原子形成的正八面体空隙中,晶胞6个表面的结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图l中原子甲的坐标为(0,0,0),原子乙的坐标为(
 ,
, ,0),则原子丙的坐标为
,0),则原子丙的坐标为②设阿伏加 德罗常数的值为NA,则该固体的密度ρ=
您最近一年使用:0次
名校
解题方法
9 . 钛被称为继铁、铝之后的第三金属,其常见的化合物有钙钛矿、硫酸氧钛(TiOSO4)、钛酸(H2TiO3)、二氧化钛(TiO2)、四氯化钛(TiCl4)等,回答下列问题:
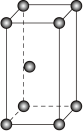
(1)基态钛原子的价层电子排布式为______ ,金属钛晶体的晶胞结构如图所示,其堆积方式名称为______ 。
(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为______ 。TiOSO4在水溶液中不稳定,易生成钛酸沉淀,该反应化学方程式为______ 。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:

化合物乙种C、N、O元素的第一电离能由大到小的顺序为______ 。化合物甲的沸点低于化合物乙的沸点,主要原因是______ 。
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为______ 晶体。将TiCl4加入盐酸中,经处理可得到一种配位数为6的绿色晶体TiCl3•6H2O,1mol该晶体恰好与含2molAgNO3的溶液反应得到白色沉淀,则该绿色晶体中配离子的化学式为______ 。
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有______ 个;若Ca与Ti的最近核间距为apm,阿伏加 德罗常数为NA,则此钙钛矿的密度为______ g•cm-3.(列出计算式即可)
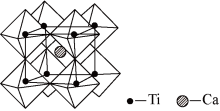
(1)基态钛原子的价层电子排布式为

(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:

化合物乙种C、N、O元素的第一电离能由大到小的顺序为
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有

您最近一年使用:0次
2020-04-03更新
|
228次组卷
|
3卷引用:云南省昆明市2020届高三“三诊一模”摸底诊断测试理综化学试题
云南省昆明市2020届高三“三诊一模”摸底诊断测试理综化学试题四川省宜宾市第四中学校2019-2020学年高二下学期期中考试化学试题(已下线)押广东卷化学第20题 物质结构与性质综合题-备战2022年高考化学临考题号押题(广东卷)
10 . 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______ 方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为_______ 。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_______ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______ 个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图: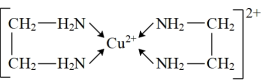 ,该配离子中含有的化学键类型有
,该配离子中含有的化学键类型有______ (填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含____ molσ键,与CO互为等电子体的离子是__ (填化学式,写一种)。
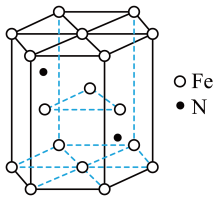
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为acm,高为ccm,阿伏加 德罗常数的值为NA,则该磁性氮化铁的晶体密度为____ g/cm3(列出计算式)。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)基态铜原子的电子排布式为
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
 ,该配离子中含有的化学键类型有
,该配离子中含有的化学键类型有A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为acm,高为ccm,阿伏加 德罗常数的值为NA,则该磁性氮化铁的晶体密度为

您最近一年使用:0次
2020-01-13更新
|
498次组卷
|
7卷引用:2019年云南省大理、丽江、怒江高中毕业生第二次复习统一检测理综化学试题



