名校
解题方法
1 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答问题:
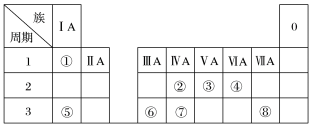
(1)地壳中含量居于第一位的元素在周期表中的位置是_______ ;
(2)画出⑤的原子结构示意图_______ ;③的最高价氧化物对应的水化物的化学式为_______ 。
(3)①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为_______ ;写出⑥的单质与⑤的最高价氧化物对应的水化物反应的离子方程式:_______ 。
(4)W是第四周期与⑧同主族的元素。据此推测W不可能 具有的性质是_______(填字母)。
(5)已知X为第ⅡA族元素(第二到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有关系:_______ 。
(6)19 g某二价金属的氯化物ACl2中含有0.4 mol Cl-,金属A的相对原子质量是_______ 。
(7)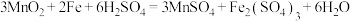 ,该反应中,每生成1mol
,该反应中,每生成1mol ,转移的电子数目为
,转移的电子数目为_______ 。

(1)地壳中含量居于第一位的元素在周期表中的位置是
(2)画出⑤的原子结构示意图
(3)①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为
(4)W是第四周期与⑧同主族的元素。据此推测W
| A.最高正化合价为+7 | B.气态氢化物比HCl稳定 |
| C.最高价氧化物对应的水化物的酸性比HClO4弱 | D.单质在常温下可与氢气化合 |
(5)已知X为第ⅡA族元素(第二到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有关系:
(6)19 g某二价金属的氯化物ACl2中含有0.4 mol Cl-,金属A的相对原子质量是
(7)
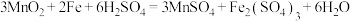 ,该反应中,每生成1mol
,该反应中,每生成1mol ,转移的电子数目为
,转移的电子数目为
您最近一年使用:0次
名校
2 . 按要求完成下列填空:
(1)①写出次氯酸的电子式_______ ;②漂粉精主要成分的化学式_______ 。
(2)写出 元素在元素周期表中的位置
元素在元素周期表中的位置_______ 。
(3) 与
与 溶液反应的化学方程式
溶液反应的化学方程式_______ 。
(1)①写出次氯酸的电子式
(2)写出
 元素在元素周期表中的位置
元素在元素周期表中的位置(3)
 与
与 溶液反应的化学方程式
溶液反应的化学方程式
您最近一年使用:0次
名校
解题方法
3 . 人体必需的一些元素在周期表中的分布情况如下:______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是________ ,原子序数为____ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。

 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将
 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性
 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。
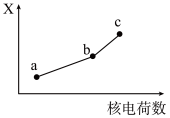
| A.若a、b、c表示氧族元素,则X表示对应氢化物的沸点 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅠA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2024-01-24更新
|
71次组卷
|
2卷引用:山东省邹城市第二中学2023-2024学年高一上学期12月月考化学试题
4 . 元素周期表是学习化学的重要工具。下表为某些元素在周期表中的位置。
(1)按①→②→③→④的顺序,其原子半径逐渐_____ (填“增大”或“减小”),得电子能力逐渐______ (填“增强”或“减弱”,下同),单质的氧化性逐渐______ ,非金属性逐渐______ ,最简单氢化物的稳定性逐渐______ 。
(2)表中化学性质最稳定的元素为___________ (填元素符号)。
(3)⑥与③形成原子个数比为1:1的化合物,属于______ 化合物(填“离子”或“共价”)其电子式为:________ ,含有的化学键________ 。
(4)⑦与⑧的最高价氧化物对应的水化物是否可以相互反应______ (填“是”或“否”)。
(5)⑨的最高价氧化物对应的水化物为________ (填化学式)。
周期 | 族 | |||||||
Ⅰ A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | 0 | |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)按①→②→③→④的顺序,其原子半径逐渐
(2)表中化学性质最稳定的元素为
(3)⑥与③形成原子个数比为1:1的化合物,属于
(4)⑦与⑧的最高价氧化物对应的水化物是否可以相互反应
(5)⑨的最高价氧化物对应的水化物为
您最近一年使用:0次
名校
5 . 下列说法是否正确(正确的打“√”,不正确的打“×”)若不正确请说明理由。
(1)元素周期表中每一横行称为一周期,每一纵列称为一个族。_________ ;
(2)FeCl3与Cu的反应为置换反应。_________ ;
(3)1 mol Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 mol/L。_________ ;
(4)镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料。_________
(1)元素周期表中每一横行称为一周期,每一纵列称为一个族。
(2)FeCl3与Cu的反应为置换反应。
(3)1 mol Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 mol/L。
(4)镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料。
您最近一年使用:0次
名校
解题方法
6 . 海洋是资源的宝库,蕴藏着丰富的氯、溴、碘等元素。氯、溴、碘是典型的非金属元素,都能与大多数金属化合生成盐,故统称为卤素;卤素单质都具有氧化性。
(1)氯在元素周期表中的位置___________
(2)氯气是重要的化工产品,工业可以由电解氯化钠溶液得到,同时还生成NaOH和H2.写出该电解过程的离子方程式___________
(3)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱顺序为: 。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式
。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式___________ 。
(4)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应: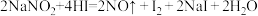
Ⅰ.上述反应的还原剂是___________
Ⅱ.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有___________ (填字母)。
A.③⑤ B.①②⑤ C.①②④
Ⅲ.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是___________ 。(填字母)
A.NaCl B. C.
C. D.浓
D.浓
(1)氯在元素周期表中的位置
(2)氯气是重要的化工产品,工业可以由电解氯化钠溶液得到,同时还生成NaOH和H2.写出该电解过程的离子方程式
(3)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱顺序为:
 。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式
。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式(4)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
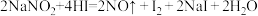
Ⅰ.上述反应的还原剂是
Ⅱ.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有
A.③⑤ B.①②⑤ C.①②④
Ⅲ.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是
A.NaCl B.
 C.
C. D.浓
D.浓
您最近一年使用:0次
名校
7 . 短周期主族元素A、B、C、D、E、F在元素周期表中的位置如下图所示,其中元素F是同周期元素原子半径最小的;请回答下列问题:
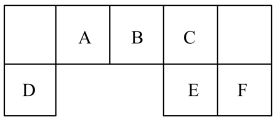
(1)F在周期表中的位置___________ ;
(2)比较B、C、D元素简单离子半径的大小顺序___________ (填写离子符号);
(3)F的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为_______________________ ;
(4)要比较元素E与F非金属性的强弱,正确合理的实验操作与现象是______________________ ;
(5)用高能射线照射液态水时,一个水分子能释放一个电子,同时产生一种具有较强氧化性阳离子,该阳离子中存在的化学键有______ ,并写出该阳离子与E的氢化物的水溶液反应的离子方程式________________ 。

(1)F在周期表中的位置
(2)比较B、C、D元素简单离子半径的大小顺序
(3)F的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为
(4)要比较元素E与F非金属性的强弱,正确合理的实验操作与现象是
(5)用高能射线照射液态水时,一个水分子能释放一个电子,同时产生一种具有较强氧化性阳离子,该阳离子中存在的化学键有
您最近一年使用:0次
名校
8 . Ⅰ.铁原子结构示意图及元素周期表中铁元素的部分信息如图。
(1)下列有关说法正确的是_______ 。
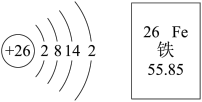
a.铁元素位于元素周期表的第六周期 b.Fe3+的电子数为24
c.1 mol铁的质量为55.85 g e.加热下,铁与硫反应生成Fe2S3
Ⅱ.碱式氯化铜[CuaClb(OH)c∙xH2O]制备需要的CuCl2可用Fe3+作催化剂得到,其催化原理如图所示。

(2)上述转化过程中Cu2+与O2个数比______ 。
(3)图中M、N分别为______ ,______ 。
(4)a、b、c之间的等式关系式为_________ 。
(5)N参加的反应离子方程式为_________ 。
(1)下列有关说法正确的是
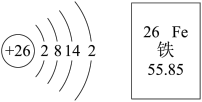
a.铁元素位于元素周期表的第六周期 b.Fe3+的电子数为24
c.1 mol铁的质量为55.85 g e.加热下,铁与硫反应生成Fe2S3
Ⅱ.碱式氯化铜[CuaClb(OH)c∙xH2O]制备需要的CuCl2可用Fe3+作催化剂得到,其催化原理如图所示。

(2)上述转化过程中Cu2+与O2个数比
(3)图中M、N分别为
(4)a、b、c之间的等式关系式为
(5)N参加的反应离子方程式为
您最近一年使用:0次
名校
9 . 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
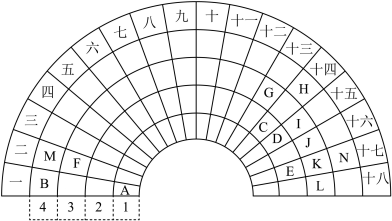
(1)表中用字母标出的14种元素中,化学性质最不活泼的是___________ (用元素符号表示,下同);常温常压下其单质为液态的非金属元素是___________ 。
(2)N的基态原子的价层电子排布式为___________ ,属于___________ 区元素。
(3)这14种元素中第一电离能最小的是___________ (用元素符号表示,下同),电负性最大的是___________ 。
(4)这些元素中的第三周期主族元素中,原子半径最小的是___________ (填元素符号),简单离子半径最小的是___________ 。(填离子符号)

(1)表中用字母标出的14种元素中,化学性质最不活泼的是
(2)N的基态原子的价层电子排布式为
(3)这14种元素中第一电离能最小的是
(4)这些元素中的第三周期主族元素中,原子半径最小的是
您最近一年使用:0次
名校
解题方法
10 . 若某非金属元素X的最高价氧化物对应的水化物的化学式为HnXOm,则X元素的族序数为______ ,它的最高价氧化物的化学式为______ ,氢化物的化学式为______ 。
您最近一年使用:0次



