名校
解题方法
1 . 下表是元素周期表短周期的一部分
(1)①-⑦元素中金属性最强的元素位于周期表中的位置为______________________ 。
(2)③与⑤形成的化合物溶于水会剧烈反应生成白色沉淀和气体A,请写出该反应的化学方程式__________ 。
(3)④所形成的单质与水反应的化学方程式为_____________ 。
(4)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是__________________ (用化学式表示);④所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是(用化学式表示)__________________ 。
(5)表中元素⑥的最高价氧化物与少量的KOH溶液反应的离子方程式为_____________ 。
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ⑧ | |||||
(2)③与⑤形成的化合物溶于水会剧烈反应生成白色沉淀和气体A,请写出该反应的化学方程式
(3)④所形成的单质与水反应的化学方程式为
(4)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是
(5)表中元素⑥的最高价氧化物与少量的KOH溶液反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
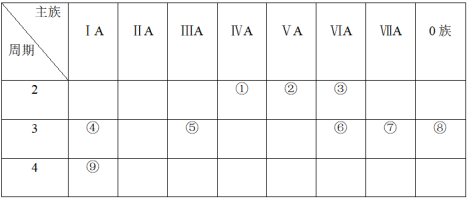
(1)在这些元素中,化学性质最不活泼的是:_______ (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______ 。碱性最强的化合物的电子式是_______ 。
(3)最高价氧化物是两性氧化物的元素是_______ ;写出它的氧化物与氢氧化钠反应的离子方程式_______ 。
(4)用电子式表示元素④与⑥的化合物的形成过程:_______ ,该化合物属于_______ (填“共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式_______ 。

(1)在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)最高价氧化物是两性氧化物的元素是
(4)用电子式表示元素④与⑥的化合物的形成过程:
(5)表示①与⑦的化合物的电子式
您最近一年使用:0次
解题方法
3 . 几种主族元素(过渡元素略去)在周期表中的位置如图:

(1)A的元素符号是_____ 。
(2)D在周期表中的位置是____ 。
(3)E、G、T的原子半径由大到小的顺序是_____ (填元素符号)。
(4)硒元素(34Se)与D同主族,其非金属性比D_____ (填“强”或“弱”)。
(5)R元素的原子结构示意图为____ 。
(6)E、D两元素能形成原子个数比2:1和1:1的两种化合物。2:1型化合物的电子式为_____ 。1:1型化合物的化学式所含化学键类型____ 。

(1)A的元素符号是
(2)D在周期表中的位置是
(3)E、G、T的原子半径由大到小的顺序是
(4)硒元素(34Se)与D同主族,其非金属性比D
(5)R元素的原子结构示意图为
(6)E、D两元素能形成原子个数比2:1和1:1的两种化合物。2:1型化合物的电子式为
您最近一年使用:0次
2021高三·全国·专题练习
4 . 表格为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中元素⑩的二价离子的外围电子排布图为:__ ,该元素属于__ 区元素。
(2)基态原子⑦核外电子总共有__ 种能量,电子占据的能量最高的能级符号为__ 。

请回答下列问题:
(1)表中元素⑩的二价离子的外围电子排布图为:
(2)基态原子⑦核外电子总共有
您最近一年使用:0次
解题方法
5 . 原子序数依次增大的A、B、C、D、E、F六种元素均为前四周期元素,A是形成化合物种类最多的元素,B与A同周期,其原子核外s能级上的电子总数与p能级上的电子总数相等,C为第3周期元素,其离子半径在该周期中最小,D原子核外p能级上的电子总数比s能级上的电子总数多2,E元素位于元素周期表中的第8列,F的单质为紫红色金属。回答下列问题:
(1)D在元素周期表中的位置为___________ 。
(2)A元素的原子核外共有___________ 种不同运动状态的电子;B元素基态原子中能量最高的电子所占据的原子轨道呈___________ 形。
(3)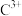 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为___________ 。
(4)E元素位于元素周期表中___________ 区(按电子排布分区),其基态原子价电子轨道表示式为___________ 。
(5)基态F原子的核外电子排布式为___________ ,其基态原子核外填充有电子的能量最高的电子层的符号为___________ ,该电子层上具有的原子轨道数是___________ 。
(1)D在元素周期表中的位置为
(2)A元素的原子核外共有
(3)
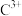 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为(4)E元素位于元素周期表中
(5)基态F原子的核外电子排布式为
您最近一年使用:0次
2021-12-03更新
|
404次组卷
|
2卷引用:山东省日照市五莲县2021-2022学年高二上学期期中考试化学试题
6 . Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为______ ,基态Co原子的价层电子排布式为______ ,与Ni同周期且与Ni具有相同未成对电子数的元素有_______ 种。
(2)Fe、Co、Ni能与Cl2反应,其中Co和Ni生成二氯化物。由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____ 。Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:_____ 。
(3)95℃时将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示。
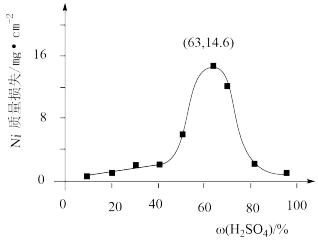
当w(H2SO4)大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____ 。由于Ni与硫酸反应很慢,而与稀HNO3反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4,为了提高产物的纯度,在硫酸中添加HNO3的方式为_____ (填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_____ 。
(1)Fe、Co、Ni在周期表中的位置为
(2)Fe、Co、Ni能与Cl2反应,其中Co和Ni生成二氯化物。由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
(3)95℃时将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示。

当w(H2SO4)大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为
您最近一年使用:0次
7 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。表中列出了a~g 7种元素在周期表中的位置。
(1)a的元素符号是_______ 。
(2)写出c单质与b的最高价氧化物水化物反应的离子方程式_______ 。
(3)d、e的最高价氧化物对应的水化物中,酸性较强的是_______ 。(填化学式)
(4)已知硒(Se)与d同主族,且位于d下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是_______ 。
① 其单质在常温下呈固态
② SeO2既有氧化性又有还原性
③ 最高价氧化物对应的水化物的化学式为H2SeO3
④ 非金属性比e元素的强
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | |||||||
| 3 | b | c | d | e |
(2)写出c单质与b的最高价氧化物水化物反应的离子方程式
(3)d、e的最高价氧化物对应的水化物中,酸性较强的是
(4)已知硒(Se)与d同主族,且位于d下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是
① 其单质在常温下呈固态
② SeO2既有氧化性又有还原性
③ 最高价氧化物对应的水化物的化学式为H2SeO3
④ 非金属性比e元素的强
您最近一年使用:0次
名校
解题方法
8 . 已知元素A、B、C、D的原子结构示意图分别为:

请回答下列问题(用元素符号回答)。
(1)写出元素的元素符号:A___________ 、B___________ 、C___________ 、D___________ 。
(2)元素A位于周期表的第___________ 周期第___________ 族。
(3)属于同周期元素的是___________ 、___________ 和___________ ,属于同主族元素的是___________ 和___________ 。
(4)属于卤族元素的是___________ 和___________ 。

请回答下列问题(用元素符号回答)。
(1)写出元素的元素符号:A
(2)元素A位于周期表的第
(3)属于同周期元素的是
(4)属于卤族元素的是
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
9 . 碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90% SrCO3,少量MgCO3、CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如下:
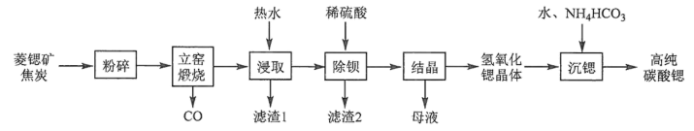
Sr(OH)2在水中的溶解度
(1)元素Sr位于元素周期表第_______ 周期第_______ 族。
(2)菱锶矿、焦炭混合粉碎的目的是_______ 。
(3)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为_______ 。进行煅烧反应的立窑衬里应选择_______ (填“石英砂砖”或“碱性耐火砖”)。

Sr(OH)2在水中的溶解度
| 温度/℃ | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度/(g/100g) | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)元素Sr位于元素周期表第
(2)菱锶矿、焦炭混合粉碎的目的是
(3)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为
您最近一年使用:0次
10 . 现有四种元素,其中A、B、C为短周期主族元素,D为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式:_____ 。
(2)B基态原子中能量最高的电子,其电子云在空间有______ 个方向,原子轨道呈______ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为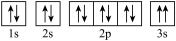 。该同学所画的电子排布图违背了
。该同学所画的电子排布图违背了____ 。
(4)D位于_______ 族_______ 区,价电子排布式为_______ 。
元素 | 相关信息 |
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B | 元素原子的核外p电子数比s电子数少1 |
C | 原子的第一至第四电离能分别是I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D | 在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 。该同学所画的电子排布图违背了
。该同学所画的电子排布图违背了(4)D位于
您最近一年使用:0次



