名校
1 . 铅的合金可作轴承、电缆外皮之用,还可做体育器材铅球等。铅元素位于元素周期表第六周期IVA,IVA中原子序数最小的元素的原子有___ 种能量不同的电子,其次外层的电子云有___ 种不同的伸展方向。与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是___ (填化学式),气态氢化物沸点最低的是___ (填化学式)。
您最近一年使用:0次
名校
2 . 回答下列问题。
Ⅰ.用“>”或“<”填空:
(1)键长:N-N___________ N=N
(2)键能:2E(C-C)___________ E(C=C)
(3)键角:CO2___________ SO2;
(4)键的极性:C-H___________ N-H。
Ⅱ.指出下列原子的杂化轨道类型及分子的空间构型。
(1)NO 中的N
中的N___________ 杂化,空间构型___________ ;
(2)BCl3中的B___________ 杂化,空间构型___________ ;
Ⅲ.已知有1H216O 3H218O S17O2 2H2S S16O2,其中包含___________ 种元素,___ 种核素,___________ 种相对分子质量。
Ⅳ.元素X的原子最外层电子排布式为nsnnpn+1.试解答下列各题:
原子中能量最高的是___________ 电子,原子轨道呈现___________ 形,它的氢化物的电子式是___________
Ⅰ.用“>”或“<”填空:
(1)键长:N-N
(2)键能:2E(C-C)
(3)键角:CO2
(4)键的极性:C-H
Ⅱ.指出下列原子的杂化轨道类型及分子的空间构型。
(1)NO
 中的N
中的N(2)BCl3中的B
Ⅲ.已知有1H216O 3H218O S17O2 2H2S S16O2,其中包含
Ⅳ.元素X的原子最外层电子排布式为nsnnpn+1.试解答下列各题:
原子中能量最高的是
您最近一年使用:0次
解题方法
3 . 硅铝合金广泛应用于航空、交通、建筑、汽车等行业。
完成下列填空:
(1)硅原子的结构示意图为___________ ;比较硅铝的原子半径:r(Si)___________ r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为___________ 。
(2)氟化铝和氯化铝的熔点分别为1040 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是___________ 。
(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为___________ ,推断的依据是___________ 。
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;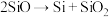 ;
;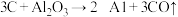
上述反应的最终还原产物为___________ ;当有1mol C参加反应时,转移的电子数目为___________ 。
完成下列填空:
(1)硅原子的结构示意图为
(2)氟化铝和氯化铝的熔点分别为1040
 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;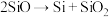 ;
;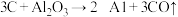
上述反应的最终还原产物为
您最近一年使用:0次
2021-04-20更新
|
416次组卷
|
3卷引用:上海市浦东新区2021届高三二模化学试题
上海市浦东新区2021届高三二模化学试题(已下线)第15讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(全国通用)上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题
解题方法
4 . (1)最外层电子数为次外层电子数 的原子
的原子___________ ;(填元素符号,下同)
(2)根据下列微粒回答问题: H、
H、 H、
H、 H、
H、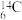 、
、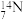 、
、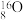 、35Cl2、37Cl2。以上8种微粒共有
、35Cl2、37Cl2。以上8种微粒共有___________ 种核素,互为同位素的___________ ,中子数相等的是___________ 。
(3)写出次氯酸结构式___________ 。
(4)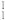 H、
H、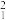 H分别用H、D符号表示,HD则属于
H分别用H、D符号表示,HD则属于___________ (单质、化合物)。
 的原子
的原子(2)根据下列微粒回答问题:
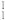 H、
H、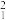 H、
H、 H、
H、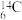 、
、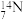 、
、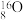 、35Cl2、37Cl2。以上8种微粒共有
、35Cl2、37Cl2。以上8种微粒共有(3)写出次氯酸结构式
(4)
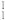 H、
H、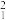 H分别用H、D符号表示,HD则属于
H分别用H、D符号表示,HD则属于
您最近一年使用:0次
5 . 工业烟气可用氯酸氧化法脱硫,涉及反应:_______ _______
_______ _______
_______ =_______
=_______ (未配平)。完成下列填空:
(未配平)。完成下列填空:
(1)写出N原子核外电子排布的轨道表示式_______ 。
(2)用含字母a、b的代数式配平上述化学方程式_______ ,标出电子转移的方向和数目_______ 。该化学方程式配平系数不唯一,请说明理由_______ 。
(3)氯酸是一元强酸,可由氯酸钡溶液和稀硫酸反应得到。写出该反应的化学方程式_______ 。
(4)工业烟气中的 也可用
也可用 和
和 的混合液脱除。
的混合液脱除。
① 脱除
脱除 的离子方程式为
的离子方程式为_______ ;
② 溶液呈碱性的原因是
溶液呈碱性的原因是_______ 。
 _______
_______ _______
_______ =_______
=_______ (未配平)。完成下列填空:
(未配平)。完成下列填空:(1)写出N原子核外电子排布的轨道表示式
(2)用含字母a、b的代数式配平上述化学方程式
(3)氯酸是一元强酸,可由氯酸钡溶液和稀硫酸反应得到。写出该反应的化学方程式
(4)工业烟气中的
 也可用
也可用 和
和 的混合液脱除。
的混合液脱除。①
 脱除
脱除 的离子方程式为
的离子方程式为②
 溶液呈碱性的原因是
溶液呈碱性的原因是
您最近一年使用:0次
2021高三·全国·专题练习
6 . 硒和铬元素都是人体必需的微量元素,硒与氧为同主族元素,硒的原子结构示意图为____ 。
您最近一年使用:0次
20-21高二·全国·单元测试
7 . 亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_______ 。
(2)黄血盐中C、N、O的第一电离能由大到小的排序为_______ ,电负性由大到小的排序为_______ 。
(1)写出基态Fe3+的核外电子排布式
(2)黄血盐中C、N、O的第一电离能由大到小的排序为
您最近一年使用:0次
名校
8 . (1)下列状态的镁中,电离最外层一个电子所需能量最大的是_____________ .
A.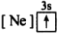 B.
B.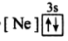 C.
C.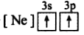 D.
D.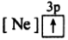
(2) 成为阳离子时首先失去
成为阳离子时首先失去____________ 轨道电子, 的价层电子排布式为
的价层电子排布式为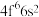 ,
,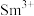 价层电子排布式为
价层电子排布式为____________ .比较离子半径:
____________ (填“大于”“小于”或“等于”) .
.
(3)在周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ ,该元素基态原子核外 层电子的自旋
层电子的自旋___________ (填“相同”或“相反”).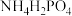 中,电负性最高的元素是
中,电负性最高的元素是___________ .
(4) 基态核外电子排布式为
基态核外电子排布式为___________ .
A.
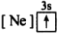 B.
B.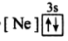 C.
C. D.
D.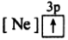
(2)
 成为阳离子时首先失去
成为阳离子时首先失去 的价层电子排布式为
的价层电子排布式为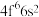 ,
,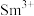 价层电子排布式为
价层电子排布式为
 .
.(3)在周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是 层电子的自旋
层电子的自旋 中,电负性最高的元素是
中,电负性最高的元素是(4)
 基态核外电子排布式为
基态核外电子排布式为
您最近一年使用:0次
2021-02-01更新
|
1079次组卷
|
4卷引用:鲁科版2019选择性必修2第1章 原子结构与元素性质 第1章学科素养提升
20-21高一·全国·课时练习
9 . 请在下列问题的横线上填上合适的短周期元素符号:
(1)某元素原子核外最外层电子数是内层电子总数的2倍,该元素可能是___________ 。
(2)某元素原子核外最外层电子数是次外层电子数的2倍,该元素可能是___________ 。
(3)某元素原子核外最外层电子数是内层电子总数的 ,该元素可能是
,该元素可能是___________ 。
(4)某元素原子核外最外层电子数是次外层电子数的 ,该元素可能是
,该元素可能是___________ 。
(1)某元素原子核外最外层电子数是内层电子总数的2倍,该元素可能是
(2)某元素原子核外最外层电子数是次外层电子数的2倍,该元素可能是
(3)某元素原子核外最外层电子数是内层电子总数的
 ,该元素可能是
,该元素可能是(4)某元素原子核外最外层电子数是次外层电子数的
 ,该元素可能是
,该元素可能是
您最近一年使用:0次
10 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2, H2与Mg在一定条件下制得储氢物质X。
回答问题: .
(1) Al在周期表中的位置______________ 。基态Zn的价层电子排布式___________ 。
(2)水分了中氧原子的杂化轨道类型_______________ 。
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有_________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是___________________ 。
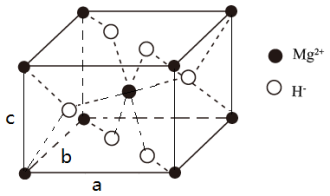
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为______________ , X的储氢质量分数是______________ ,c= ___________ pm (列出计算式即可)。
回答问题: .
(1) Al在周期表中的位置
(2)水分了中氧原子的杂化轨道类型
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为

您最近一年使用:0次
2020-10-12更新
|
4079次组卷
|
5卷引用:难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)
(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)北京市第一六一中学2021-2022学年高三上学期期中考试化学试题2020年海南省高考化学试卷(新高考)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)2020年海南卷化学高考真题变式题15-19



