名校
1 . 根据原子核外电子排布规则,回答下列问题:
(1)写出基态S原子的核外电子排布式:_____________ ;写出基态24Cr原子的价层电子轨道表示式:_____________ ;写出基态Ga原子的价层电子排布图:_____________ 。
(2)基态碳原子的轨道表示式: ,该轨道表示式违背了
,该轨道表示式违背了___________ 。
(3)Ca(CN)2是离子化合物,其中CN-内部各原子均满足8电子稳定结构,Ca(CN)2的电子式是_______________ 。
(4)H2O的热稳定性大于H2S,从物质结构角度说明原因:____________________________ 。
(1)写出基态S原子的核外电子排布式:
(2)基态碳原子的轨道表示式:
 ,该轨道表示式违背了
,该轨道表示式违背了(3)Ca(CN)2是离子化合物,其中CN-内部各原子均满足8电子稳定结构,Ca(CN)2的电子式是
(4)H2O的热稳定性大于H2S,从物质结构角度说明原因:
您最近一年使用:0次
9-10高二下·黑龙江·期末
名校
解题方法
2 . 下列说法中,正确的是
| A.处于最低能量的原子叫做基态原子 |
B. 表示 表示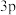 能级有两个轨道 能级有两个轨道 |
| C.同一原子中,1s、2s、3s电子的能量逐渐减小 |
| D.2p、3p、4p能级的轨道数依次增多 |
您最近一年使用:0次
2021-12-03更新
|
1620次组卷
|
46卷引用:甘肃省酒泉市青海油田第一中学2020-2021学年高二下学期期中考试化学试题
甘肃省酒泉市青海油田第一中学2020-2021学年高二下学期期中考试化学试题新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 (已下线)2014-2015学年四川省邛崃市高二上学期半期考试化学试卷2015-2016学年河北邢台一中高二上学期期中测试化学试卷河南省郑州市八校2016-2017学年高二下学期期中联考化学试题【全国百强校】辽宁省鞍山市第一中学2017-2018学年高二下学期期中考试化学试题【全国百强校】辽宁省葫芦岛市第一高级中学2017-2018学年高二下学期期中考试化学试题黑龙江省哈尔滨市阿城区第二中学2018-2019学年高二下学期期中考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题新疆昌吉市教育共同体2019-2020学年高二下学期期中考试化学试题天津市滨海新区2020-2021学年高二上学期期末考试化学试题陕西省西安中学2020-2021学年高二上学期期末考试化学试题(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)1.1 原子结构(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)福建省泉州市四校(晋江磁灶中学等)2019-2020学年高二下学期期中联考化学试题福建省福州市福清西山学校2020-2021学年高二下学期3月月考化学试题黑龙江省齐齐哈尔市第一中学2020-2021学年高二下学期4月月考化学试题人教2019选择性必修2第一章 原子结构与性质复习与提高(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)山西省晋城市第一中学2021-2022学年高二上学期第五次调研化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高二下学期期中考试化学试题福建省永春美岭中学2021-2022学年高二下学期期中测试化学试题2019鲁科版高中化学选择性必修2第1章本章自我评价课后习题广东省广州市白云中学2022-2023学年高二下学期期中考试化学试题(已下线)09—10年哈三中高二下学期期末考试化学卷(已下线)2011-2012学年陕西省宝鸡中学高二下学期期末考试化学试卷(已下线)2014学年高二鲁科版选修3化学规范训练 1章原子结构练习卷吉林省东北师范大学附属中学2017-2018学年高二上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高二上学期期末考试化学试题河北省邢台市第一中学2017-2018学年高二下学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学2017-2018学年高二3月月考化学试题贵州省习水县一中2018-2019学年高二上学期12月份月考化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题云南省昭通市绥江县二中2019-2020学年高二上学期期末考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题新疆维吾尔自治区喀什巴楚县第一中学2020-2021学年高二上学期第一次月考化学试题湖北省黄冈市麻城市第二中学2021-2022学年高二下学期3月月考化学试题 新疆新源二中2021-2022学年高二下学期期末测试化学试题新疆生产建设兵团第六师芳草湖农场中学2021-2022学年高二上学期期末考试化学试题天津市南开大学附属中学2022-2023学年高二上学期期末考试化学试卷贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考化学试题甘肃省张掖市 高台县第一中学2022-2023学年高二下学期3月月考化学试题新疆博湖县奇石中学2022-2023学年高二下学期期末考试化学试题黑龙江省齐齐哈尔市第八中学校2023-2024学年高二下学期三月月考化学试题
名校
3 . 元素周期表中第四周期的某些过渡元素(如Ti、Co等)在生产、生活中有着广泛的应用。Co2+能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
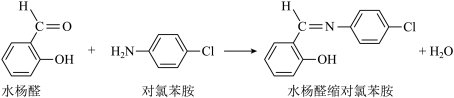
(1)基态Co2+核外电子排布式_______ ;C原子的轨道表示式为_______ ;C、N、O元素的电负性由大到小的顺序为_______ 。
(2)水杨醛所含的官能团为_______ 。
(3)1mol水杨醛最多与_______ H2发生加成反应。
(4)一定条件下,水杨醛缩对氯苯胺与足量NaOH溶液反应的化学方程式_______ 。

(1)基态Co2+核外电子排布式
(2)水杨醛所含的官能团为
(3)1mol水杨醛最多与
(4)一定条件下,水杨醛缩对氯苯胺与足量NaOH溶液反应的化学方程式
您最近一年使用:0次
4 . 在建国 70周年阅兵仪式上,“歼20”“东风-41核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属A1-Cu-Mg-Zn系。Cu在元素周期表中的位置是___________ ,比较第一电离能Al___________ Mg (填“>”“<”“=”)。
(2)查阅资料显示第二电离能Cu大于Zn,理由是___________ 。
(3)中期战斗机主要采用钛合金,Ti的价电子排布图为___________ 。钛晶体在882 °C以 上为体心立方的β钛,其中钛原子的配位数为___________ 。
(4)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成Ti (SO4)2、 NiSO4,其中阴离子中心S的___________ 杂化轨道与O的2p轨道形成___________ 键(填“π”或“σ”)。
(5)一种钛镍合金的立方晶胞结构如图所示,若晶胞的边长为a pm,则晶胞的密度为___________ g/cm3(用含a、NA的计算式表示)。
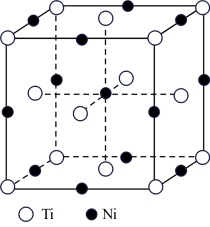
(1)早期战斗机主要采用铝合金,其中超硬铝属A1-Cu-Mg-Zn系。Cu在元素周期表中的位置是
(2)查阅资料显示第二电离能Cu大于Zn,理由是
(3)中期战斗机主要采用钛合金,Ti的价电子排布图为
(4)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成Ti (SO4)2、 NiSO4,其中阴离子中心S的
(5)一种钛镍合金的立方晶胞结构如图所示,若晶胞的边长为a pm,则晶胞的密度为

您最近一年使用:0次
名校
解题方法
5 . 下列化学用语表示正确的是
A.CCl4的比例模型 |
B.Fe2+的外围电子轨道表达式: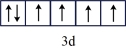 |
C.Na2O2的电子式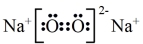 |
| D.124 g P4 (正四面体)中P-P键数目为4NA |
您最近一年使用:0次
名校
6 . 氧化钴(Co2O3 )在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石(主要成分为CoO(OH)、CoCO3 、Cu2(OH)2CO3和 SiO2,还有少量 Fe、Mg、Ca 的氧化物)为原料制备氧化钴(Co2O3 )的工艺流程如图所示:
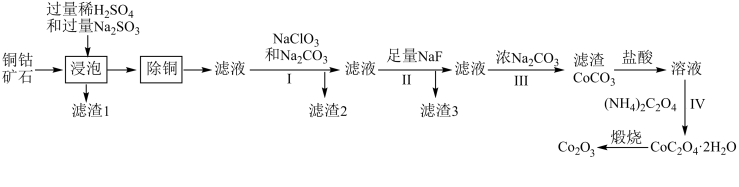
已知:常温下 Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36。
请回答下列问题:
(1)基态钴原子的价电子轨道表示式为_______ ;钴的第四电离能I4(Co)小于铁的第四电离能I4(Fe),其理由是_______ 。
(2)“浸泡”过程中,所得滤渣1中的物质是_______ ,写出此过程中 CoO(OH)与 Na2SO3反应的离子方程式_______ 。
(3)“除铜”过程中需加入 FeS 固体,写出该过程发生反应的离子方程式_______ 。
(4)步骤 I 中加入 NaClO3后适当加热的作用是_______ ;过程 III 中加入 Na2CO3得到滤渣后又加入盐酸溶解,其目的是_______ 。
(5)已知某温度下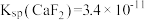 ,
,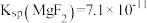 。该温度下,步骤Ⅱ中加入足量的
。该温度下,步骤Ⅱ中加入足量的 溶液可将
溶液可将 、
、 沉淀除去,若所得滤液中
沉淀除去,若所得滤液中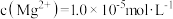 ,则滤液中
,则滤液中 为
为_______ (保留2位有效数字)。

已知:常温下 Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36。
请回答下列问题:
(1)基态钴原子的价电子轨道表示式为
(2)“浸泡”过程中,所得滤渣1中的物质是
(3)“除铜”过程中需加入 FeS 固体,写出该过程发生反应的离子方程式
(4)步骤 I 中加入 NaClO3后适当加热的作用是
(5)已知某温度下
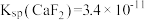 ,
,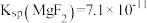 。该温度下,步骤Ⅱ中加入足量的
。该温度下,步骤Ⅱ中加入足量的 溶液可将
溶液可将 、
、 沉淀除去,若所得滤液中
沉淀除去,若所得滤液中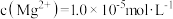 ,则滤液中
,则滤液中 为
为
您最近一年使用:0次
名校
解题方法
7 . “医用酒精"和84消毒液”混合,产生QW、Y2X4Z、YX3W等多种物质。已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素。下列正确的是
| A.Y2X4Z中σ键和π键数目之比5:1 |
B.基态Y原子的价电子轨道表示式 ,不符合泡利原理 ,不符合泡利原理 |
| C.YX3W分子的空间构型为正四面体 |
| D.Z与Q形成的常见化合物中阴阳离子个数比为1:2 |
您最近一年使用:0次
名校
解题方法
8 . 氟及其化合物用途十分广泛,回答下列问题:
(1)CuF的熔点为1008℃,熔化呈液态时能导电。CuCl的熔点为326℃,能升华,熔化呈液态时不导电;
①CuF中Cu+的基态价电子排布图为:_______ , 铜元素位于元素周期表_______ 区;
②CuF的熔点比CuCl的高,原因是_______ 。
(2)[H2F]+[SbF6]-(氟锑酸 是一种超强酸,阳离子
是一种超强酸,阳离子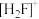 的空间构型为
的空间构型为_______ 。基态氟原子核外电子占据最高能级的电子云形状为_______ 形。
(3)工业上电解 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石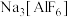 降低
降低 的熔点。通常将Al(OH)3和Na2CO3一同溶于氢氟酸来制取冰晶石,反应时放出CO2气体,写出该反应的化学方程式:
的熔点。通常将Al(OH)3和Na2CO3一同溶于氢氟酸来制取冰晶石,反应时放出CO2气体,写出该反应的化学方程式: _______ ;
(4)硒化锌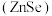 是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,若A点坐标为(0,0,0),B点坐标为
是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,若A点坐标为(0,0,0),B点坐标为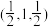 ,则 D点坐标为
,则 D点坐标为_______ 。
(甲)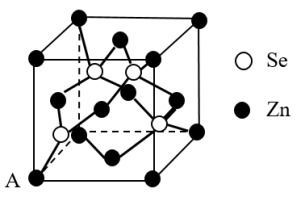 (乙)
(乙)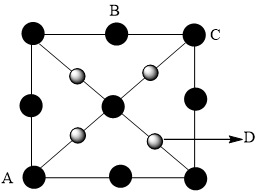
(5)CaF2的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为a nm,则
的最近核间距为a nm,则 的摩尔质量为
的摩尔质量为_______ g/mol  列出代数式,设
列出代数式,设 为阿伏加德罗常数的值
为阿伏加德罗常数的值 。
。
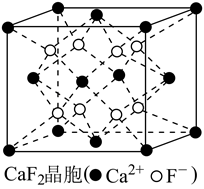
(1)CuF的熔点为1008℃,熔化呈液态时能导电。CuCl的熔点为326℃,能升华,熔化呈液态时不导电;
①CuF中Cu+的基态价电子排布图为:
②CuF的熔点比CuCl的高,原因是
(2)[H2F]+[SbF6]-(氟锑酸
 是一种超强酸,阳离子
是一种超强酸,阳离子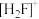 的空间构型为
的空间构型为(3)工业上电解
 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石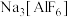 降低
降低 的熔点。通常将Al(OH)3和Na2CO3一同溶于氢氟酸来制取冰晶石,反应时放出CO2气体,写出该反应的化学方程式:
的熔点。通常将Al(OH)3和Na2CO3一同溶于氢氟酸来制取冰晶石,反应时放出CO2气体,写出该反应的化学方程式: (4)硒化锌
 是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,若A点坐标为(0,0,0),B点坐标为
是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,若A点坐标为(0,0,0),B点坐标为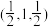 ,则 D点坐标为
,则 D点坐标为(甲)
 (乙)
(乙)
(5)CaF2的晶胞如图所示,密度为
 ,相邻的两个
,相邻的两个 的最近核间距为a nm,则
的最近核间距为a nm,则 的摩尔质量为
的摩尔质量为 列出代数式,设
列出代数式,设 为阿伏加德罗常数的值
为阿伏加德罗常数的值 。
。
您最近一年使用:0次
名校
解题方法
9 . 铝硅酸盐型分子筛的吸附能力高、选择性强、耐高温。广泛用于有机化工和石油化工。钙铝硅酸盐型分子筛化学纠成可表示为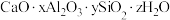 。回答下列问题:
。回答下列问题:
(1) 与
与 同主族,基态
同主族,基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ ,晶体硅和碳化硅熔点较高的是___________ (填化学式)。
(2)O元素能与卤素形成多种氧化物, 分子中
分子中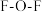 的键角
的键角___________ (填“大于”或“小于”) 分子中
分子中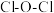 的键角,原因是
的键角,原因是___________ 。
(3)在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成 型化学键,这种不局限在两个原子之间的
型化学键,这种不局限在两个原子之间的 键称为离域
键称为离域 键,或大
键,或大 键。下列微粒中不存在离域
键。下列微粒中不存在离域 键的是___________(填序号)
键的是___________(填序号)
(4)金属钙在空气中燃烧除有氧化物生成外,还有氮化物生成,因此在电子工业中常用钙除去体系中不必要的氧气和氮气。钙与氮气化合所得氮化钙的晶胞结构如图所示。该晶体属立方晶系, 的半径为
的半径为 ,晶胞棱边夹角均为90°。
,晶胞棱边夹角均为90°。 与
与 间的作用力为
间的作用力为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为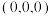 ,则B点原子的分数坐标为
,则B点原子的分数坐标为___________ 。阿伏加德罗常数的值为 ,该晶体的密度
,该晶体的密度___________  (写出表达式)。
(写出表达式)。

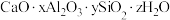 。回答下列问题:
。回答下列问题:(1)
 与
与 同主族,基态
同主族,基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)O元素能与卤素形成多种氧化物,
 分子中
分子中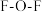 的键角
的键角 分子中
分子中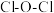 的键角,原因是
的键角,原因是(3)在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成
 型化学键,这种不局限在两个原子之间的
型化学键,这种不局限在两个原子之间的 键称为离域
键称为离域 键,或大
键,或大 键。下列微粒中不存在离域
键。下列微粒中不存在离域 键的是___________(填序号)
键的是___________(填序号)A. | B.. (白磷分子) (白磷分子) | C. | D. |
 的半径为
的半径为 ,晶胞棱边夹角均为90°。
,晶胞棱边夹角均为90°。 与
与 间的作用力为
间的作用力为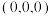 ,则B点原子的分数坐标为
,则B点原子的分数坐标为 ,该晶体的密度
,该晶体的密度 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
名校
10 . X、Y、Z、W为原子序数依次增大的前四周期元素,X的一种单质是天然存在的最坚硬矿物质,Z原子最外层电子数为次外层电子数的三倍,W基态原子的价电子排布为3d64s2。下列说法正确的是
| A.原子半径:Z>Y>X |
| B.元素的第一电离能:Z>Y>X |
| C.X、Y最简单气态氢化物分子的键角:X>Y |
D.W2+价电子轨道表示式: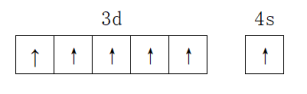 |
您最近一年使用:0次
2021-11-18更新
|
871次组卷
|
3卷引用:江苏省镇江市2021-2022学年高三上学期期中考试化学试题
江苏省镇江市2021-2022学年高三上学期期中考试化学试题(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)湖南省常德市桃源县第一中学2022-2023学年高三上学期10月月考化学试题



