解题方法
1 . 镍具有良好的导磁性和可塑性,主要用于制作合金及催化剂。请回答下列问题
(1)基态镍原子的价电子排布图为____ ,同周期元素中基态原子与镍具有相同未成对电子的还有____ 种。
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为___ 三种组成元素按电负性由大到小的顺序为____ 。
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为____ ,写出与SO42-互为等电子体的一种分子和一种离子的化学式____ ,____ ;[Ni(
NH3)4]SO4中H-N-H键之间的夹角___ (填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角。
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的____ 体空隙中,其空隙的填充率为____ 。
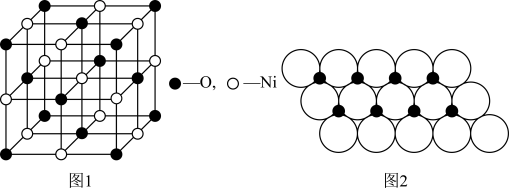
(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为___ g。(用a、NA表示)
(1)基态镍原子的价电子排布图为
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为
NH3)4]SO4中H-N-H键之间的夹角
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的

(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为
您最近一年使用:0次
9-10高二下·河南郑州·期末
名校
解题方法
2 . 有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________ ,B是________ ,E是_________ 。
(2) 写出C元素基态原子的电子排布式_________________________ 。
(3)写出D元素原子的价电子排布图____________________ 。
(4) 元素B与D的电负性的大小关系是___________ ,C与E的第一电离能的大小关系是___________ 。(填“>”、“<”或“=”)
(1)A是
(2) 写出C元素基态原子的电子排布式
(3)写出D元素原子的价电子排布图
(4) 元素B与D的电负性的大小关系是
您最近一年使用:0次
2019-04-28更新
|
125次组卷
|
4卷引用:河北省唐山市开滦第二中学2018-2019学年高二下学期期中考试化学试题
河北省唐山市开滦第二中学2018-2019学年高二下学期期中考试化学试题(已下线)2010年郑州市智林学校高二下学期期末考试化学试题四川省成都市双流棠湖中学2019-2020学年高二下学期第二次月考化学试题福建省福州福清市2017-2018学年高二下学期期中考试化学试题
解题方法
3 . 镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________ ,基态Fe3+有_____ 种不同运动状态的电子,基态铬原子有__________ 个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________ (填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________ 、___________________ 。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________ 晶体,组成Ni(CO)4 的三种元素电负性由大到小的顺序为_______________ (填元素符号),CO 分子中π键与σ键的个数比为_______________ 。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________ 空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏伽德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________ 。
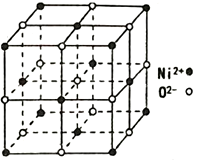
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的

您最近一年使用:0次
2018-03-04更新
|
260次组卷
|
2卷引用:河北省唐山市2018届高三上学期期末考试理综化学试题
名校
4 . 下列元素电负性最大的是
| A.C | B.F | C.Cl | D.N |
您最近一年使用:0次
2020-04-28更新
|
82次组卷
|
3卷引用:河北省唐山市开滦第二中学2017-2018学年高二4月月考化学试题
名校
解题方法
5 . 四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________ 、________ ;杂化轨道分别是________ 、________ ;a分子的立体结构是________ 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________ 晶体、________ 晶体。
(3)Y与Z比较,电负性较大的是________ ,W2+离子的核外电子排布式是________ 。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)Y与Z比较,电负性较大的是
您最近一年使用:0次
名校
6 . 前四周期元素X、Y、Z、M、N、O、P,原子序数逐渐增大,其中X、Y、Z、M、N为短周期元素,而X、Y、Z、M处于同周期的P区,且未成对电子数之比为1:2:3:2;N与Z同族。O、P分别位于周期表第2、4列,P的单质被称为“未来金属”,具有质量轻、强度大、耐腐蚀性好的优点。
(1)Y、Z、M三种元素的电负性由大到小的顺序:________ (用元素符号表示)。
(2)M的常见氢化物的氢键的键能小于HF的氢键的键能,但Z的常见氢化物常温下为液态而HF常温下为气态的原因是:__________ 。
(3)XN一种耐磨涂料,可用于金属表面保护层,该化合物可由X的三溴化物和N的三溴化物于高温下在氢气的氛围中合成。
①写出合成XN的化学方程式:_________ 。(各物质用化学式表示)
②XN的晶体的晶胞如图所示:
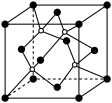
其中实心球为N,在一个晶胞中N原子空间堆积方式为______ ,N原子的配位数为______ ;该结构中有一个配位键,提供空轨道的原子是________ (写元素符号)。

(4)O和硫形成的某种晶体的晶胞如图a所示:该晶胞原子的坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为_______ 。
(5)图b为P的一种面心立方晶胞结构,若晶胞的边长为anm,则P的密度为_____ g·cm-3(用含a和NA的代数式表示)
(1)Y、Z、M三种元素的电负性由大到小的顺序:
(2)M的常见氢化物的氢键的键能小于HF的氢键的键能,但Z的常见氢化物常温下为液态而HF常温下为气态的原因是:
(3)XN一种耐磨涂料,可用于金属表面保护层,该化合物可由X的三溴化物和N的三溴化物于高温下在氢气的氛围中合成。
①写出合成XN的化学方程式:
②XN的晶体的晶胞如图所示:

其中实心球为N,在一个晶胞中N原子空间堆积方式为

(4)O和硫形成的某种晶体的晶胞如图a所示:该晶胞原子的坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
(5)图b为P的一种面心立方晶胞结构,若晶胞的边长为anm,则P的密度为
您最近一年使用:0次
2019-06-20更新
|
84次组卷
|
2卷引用:河北省唐山市开滦第二中学2018-2019学年高二6月月考化学试题
名校
7 . 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于________ 区。某一次性电池负极材料是Zn,正极材料是Mn的一种常见氧化物,放电后生成MnOOH,电解质是KOH。该电池的正极反应式为__________________________ 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为________ ,该能层具有的原子轨道数为________ 。BH4-的立体构型是________ 。
(3)单质Cu的晶体类型为______ ,晶体中组成微粒通过________ 作用形成面心立方密堆积,其中Cu原子的配位数为______ 。在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是________ ,乙醛分子中∠HCO的键角________ 乙醇分子中∠HCO的键角(填“大于”、“等于”或“小于”)。
(4)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为________ ,δ、γ、α三种晶胞的边长之比为________ 。
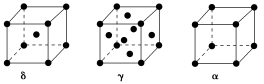
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为
(3)单质Cu的晶体类型为
(4)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为

您最近一年使用:0次
8 . A、B、C、D为原子序数依次增大的四种短周期元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_______ (填元素符号),其中D原子的核外电子排布式为_________ 。
(2)单质A有两种同素异形体,其中沸点较高的是_______ (填分子式),原因是_______ ;
(3)B和D的氢化物所属的晶体类型分别为________ 和_______ 。
(4)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为__________ ,D的价层电子轨道表达式_______ 。
(5)A和B能够形成只含离子键的化合物M,电子式为_______ ,其晶胞结构如图所示,晶胞参数边长a=0.566 nm,列式计算晶体M的密度(g·cm-3):________ (列计算式)。

(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点较高的是
(3)B和D的氢化物所属的晶体类型分别为
(4)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(5)A和B能够形成只含离子键的化合物M,电子式为

您最近一年使用:0次
名校
解题方法
9 . 前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价电层电子均已成对。
回答下列问题:
(1)E2+的外围电子排布图为________________ 。
(2)五种元素中电负性最小的是________ (填元素符号),CAB-离子中,A原子的杂化方式是________ 。
(3)AB-、D+和E2+三种离子组成的化学物质D2E(AB)4,该化合物中存在一个复杂离子,该离子的化学式为________ ,配位体是________ 。
(4)C和E两种元素组成的一种化合物的晶胞如图所示。
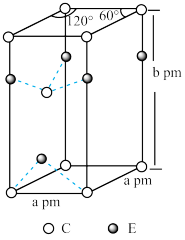
①该化合物的化学式为________ ,E的配位数为________ ,C采取________ (填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)堆积;
②列式表示该晶体的密度:________ g·cm-3。(NA表示阿伏伽德罗常数的值)
回答下列问题:
(1)E2+的外围电子排布图为
(2)五种元素中电负性最小的是
(3)AB-、D+和E2+三种离子组成的化学物质D2E(AB)4,该化合物中存在一个复杂离子,该离子的化学式为
(4)C和E两种元素组成的一种化合物的晶胞如图所示。

①该化合物的化学式为
②列式表示该晶体的密度:
您最近一年使用:0次
名校
10 . 利用电负性数值可以预测
| A.分子的极性 | B.分子的对称性 |
| C.分子的空间构型 | D.化学键的极性 |
您最近一年使用:0次
2016-12-09更新
|
180次组卷
|
5卷引用:河北省唐山市开滦第二中学2017-2018学年高二4月月考化学试题



