名校
1 . X、Y、Z、W四种元素位于元素周期表前四周期,原子序数依次增大。基态X原子价电子排布式为 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素。
(1) 分子的空间构型为
分子的空间构型为_______ 。
(2)阴离子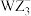 中W原子的杂化类型为
中W原子的杂化类型为_______ 。
(3) 的沸点比Z同主族其他元素氢化物高,原因是
的沸点比Z同主族其他元素氢化物高,原因是_______ 。
(4) 分子中各原子都满足最外层8电子结构,分子中π键与σ键数目之比为
分子中各原子都满足最外层8电子结构,分子中π键与σ键数目之比为_______ 。
 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素。(1)
 分子的空间构型为
分子的空间构型为(2)阴离子
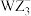 中W原子的杂化类型为
中W原子的杂化类型为(3)
 的沸点比Z同主族其他元素氢化物高,原因是
的沸点比Z同主族其他元素氢化物高,原因是(4)
 分子中各原子都满足最外层8电子结构,分子中π键与σ键数目之比为
分子中各原子都满足最外层8电子结构,分子中π键与σ键数目之比为
您最近一年使用:0次
名校
2 . 下列对一些事实的理论解释正确的是
| 选项 | 事实 | 理论解释 |
| A | 硫酸铵晶体中存在氢键 |  中的H与 中的H与 中的O之间的作用力大小在范德华力和共价键之间 中的O之间的作用力大小在范德华力和共价键之间 |
| B | 熔融NaCl可以导电 | 熔融态NaCl中有自由移动的电子 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是共价晶体 |
| D | HF的沸点高于HCl | F的电负性大于Cl |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-29更新
|
164次组卷
|
3卷引用:河北省唐山市十县一中联盟2022-2023学年高二下学期期中考试化学试题
河北省唐山市十县一中联盟2022-2023学年高二下学期期中考试化学试题江西省高安市灰埠中学2022-2023学年高二下学期5月期中考试化学试题(已下线)2023年北京卷高考真题变式题(选择题6-10)
名校
3 . 现有三种元素基态原子的电子排布式:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。下列有关比较正确的是
| A.第一电离能:③>②>① | B.原子半径:①>②>③ |
| C.电负性:③>①>② | D.最高正化合价:③>②>① |
您最近一年使用:0次
4 . 下列有关微粒性质的排列顺序错误的是
| A.键角:NCl3>PCl3 | B.沸点:H2O>H2Se>H2S |
| C.电负性:C<N<O<F | D.第一电离能:N<O<F<Ne |
您最近一年使用:0次
解题方法
5 . “玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为___ ,基态Ga原子核外有__ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol−1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__ 和+3,砷的电负性比镓__ (填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3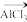 CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为__ ;AsCl3分子的空间构型为___ 。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为____ 。
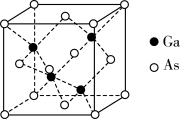
(5)GaAs为原子晶体,密度为ρg·cm−3,其晶胞结构如图所示,Ga与As以___ 键键合。在晶胞中,距离Ga原子距离最近且相等的As原子有___ 个。
(1)基态As原子的价电子排布图为
(2)镓失去电子的逐级电离能(单位:kJ·mol−1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为
(3)1918年美国人通过反应:HC≡CH+AsCl3
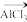 CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为
(5)GaAs为原子晶体,密度为ρg·cm−3,其晶胞结构如图所示,Ga与As以

您最近一年使用:0次
2020-09-27更新
|
416次组卷
|
2卷引用:河北省遵化市2019-2020学年高二下学期期末考试化学试题
名校
解题方法
6 . 硼族元素及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子排布式为__________ ,B原子核外电子有_______ 个不同的能级。
(2)硼、铝同主族,晶体硼的熔点为2300℃,金属铝的熔点为660.3℃,试解释其原因:__________________________________________________ 。
(3)氨硼烷(NH3·BH3)是一种高性能新型储氢材料,其中硼原子的杂化方式为____________ 。三种元素的电负性由小到大顺序为________________ ,写出一种与氨硼烷互为等电子体的分子__________ (填化学式)。
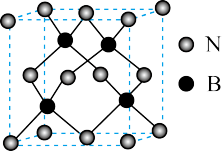
(4)氮化硼(BN)晶体是一种特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如下图所示。
①氮化硼晶体中六个面心的氮原子构成的几何形状为__________ 。
②已知立方氮化硼晶体中晶胞密度为d g·cm-3,阿伏加 德罗常数值为NA,则该晶体中距离最近的B原子与N原子之间的球心距离表达式为__________ nm。
(1)基态B原子的价电子排布式为
(2)硼、铝同主族,晶体硼的熔点为2300℃,金属铝的熔点为660.3℃,试解释其原因:
(3)氨硼烷(NH3·BH3)是一种高性能新型储氢材料,其中硼原子的杂化方式为
(4)氮化硼(BN)晶体是一种特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如下图所示。
①氮化硼晶体中六个面心的氮原子构成的几何形状为
②已知立方氮化硼晶体中晶胞密度为d g·cm-3,阿伏加 德罗常数值为NA,则该晶体中距离最近的B原子与N原子之间的球心距离表达式为

您最近一年使用:0次
2020-09-25更新
|
417次组卷
|
3卷引用:河北省唐山市2021届高三上学期第一次摸底考试化学试题
真题
名校
7 . 在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
| A.Li,F | B.Na,F | C.Na,Cl | D.Mg,O |
您最近一年使用:0次
2019-01-30更新
|
744次组卷
|
19卷引用:2013-2014河北省唐山一中下学期高二期末考试化学试卷
(已下线)2013-2014河北省唐山一中下学期高二期末考试化学试卷2009年普通高等学校招生统一考试化学试题(海南卷)(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷2015-2016学年陕西省西安高中高二下期末化学试卷【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】河北省冀州市中学2018-2019学年高二上学期第六次月考化学试题云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)(已下线)模块同步卷06 阶段性检测卷-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省福州高级中学2020-2021学年高二下学期期中考试化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题四川省绵阳中学2022-2023学年高二上学期9月线上测试化学试题2.3离子键、配位键与金属键(课后)-鲁科版选择性必修2上海中学东校2023-2024学年高三上学期9月月考化学试题
解题方法
8 . 铜及其化合物有许多特殊用途,最近科研人员用CuP2作电极电催化CO2,CO2经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为Cu3(PO4)2和Cu2O。回答下列问题:。
(1)基态磷原子的价电子排布图为___________ ,基态Cu原子电子占据最高能级的电子云轮廓图为___________ 形。
(2)Cu、O、P三种元素中,电负性由大到小的顺序为___________ ,C、O、P最简单氢化物的沸点由大到小的顺序为___________ 。(用“>”连接氢化物化学式)。
(3) 的空间构型为
的空间构型为___________ ,其中P采取___________ 杂化方式。
(4)1-丁醇、1-氯丁烷的沸点依次为118°C、78.2°C,前者沸点较高的原因是___________ 。
(5)Cu、Mn、Al形成的一种金属间化合物的晶体结构如图所示。已知晶胞参数为apm,内部正方形的边长为bpm,NA表示阿伏加德罗常数。

该晶体的密度为___________ (用含a、NA的代数式表示);P、Q间的距离为___________ pm。
(1)基态磷原子的价电子排布图为
(2)Cu、O、P三种元素中,电负性由大到小的顺序为
(3)
 的空间构型为
的空间构型为(4)1-丁醇、1-氯丁烷的沸点依次为118°C、78.2°C,前者沸点较高的原因是
(5)Cu、Mn、Al形成的一种金属间化合物的晶体结构如图所示。已知晶胞参数为apm,内部正方形的边长为bpm,NA表示阿伏加德罗常数。

该晶体的密度为
您最近一年使用:0次
名校
9 . 下列各组元素中,电负性依次减小的是
| A.O、Cl、H | B.K、Na、Al | C.As、P、H | D.O、S、Cl |
您最近一年使用:0次
2020-04-27更新
|
378次组卷
|
11卷引用:河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题
河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题2015-2016学年湖北省长阳一中高二第一学期第一次月考化学试卷2014-2015学年宁夏平罗中学高二上学期期中化学试卷海南省三亚华侨学校2019-2020学年高二上学期期中考试化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题新疆喀什地区巴楚县第一中学2020-2021学年高二上学期期中考试化学试题海南省海南鑫源高级中学2020-2021学年高二下学期第一次月考化学试题福建省福州市金山中学2020-2021学年高二下期中考试化学试题第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律1.3.2元素的电离能、电负性及其变化规律(课中)-鲁科版选择性必修21.2.2 元素周期律-课堂例题
名校
解题方法
10 . VCU研发的锂超离子导体Li3SBF4,提升了固态电解质导电性,其制备反应为LiBF4+Li2S=Li3SBF4。
回答下列问题:
(1)基态硫原子中核外电子有____ 种运动状态;组成锂超离子导体的四种元素中,电负性最大的元素的价层电子排布式为____ 。
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是____ (填化学式),该分子的中心原子的价层电子对数是____ ;含F有机酸CF3COOH比CCl3COOH的酸性____ (填“强”或“弱”),原因为____ 。
(3)BF3与F-形成 时,二者形成的化学键为
时,二者形成的化学键为____ 键,提供电子对的原子为____ (填元素符号), 中B的杂化方式为
中B的杂化方式为____ 。
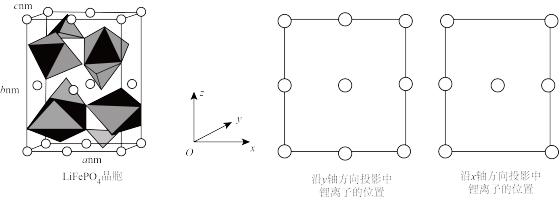
(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为___ 、___ ;设NA为阿伏加德罗常数的值,LiFePO4的密度ρ=___ g•cm-3(用含a、b、c、NA的代数式表示)。
回答下列问题:
(1)基态硫原子中核外电子有
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是
(3)BF3与F-形成
 时,二者形成的化学键为
时,二者形成的化学键为 中B的杂化方式为
中B的杂化方式为(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为

您最近一年使用:0次



