名校
解题方法
1 . 前四周期元素X、Y、Z、W的原子序数依次增大,基态X原子的电子层数、能级数目和轨道数目均相等,Z可与X形成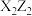 、
、 两种无色化合物,基态Y、W原子均满足最高能级的半满状态,但Y的内层轨道全充满,W的未成对电子数在前四周期元素中最多。下列说法正确的是
两种无色化合物,基态Y、W原子均满足最高能级的半满状态,但Y的内层轨道全充满,W的未成对电子数在前四周期元素中最多。下列说法正确的是
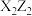 、
、 两种无色化合物,基态Y、W原子均满足最高能级的半满状态,但Y的内层轨道全充满,W的未成对电子数在前四周期元素中最多。下列说法正确的是
两种无色化合物,基态Y、W原子均满足最高能级的半满状态,但Y的内层轨道全充满,W的未成对电子数在前四周期元素中最多。下列说法正确的是A.第一电离: ,电负性: ,电负性: |
B. 、 、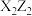 均为只含有极性键的极性分子 均为只含有极性键的极性分子 |
C.Y、Z分别与X形成的简单化合物的稳定性:前者 后者 后者 |
D.W元素属于元素周期表 区的金属元素 区的金属元素 |
您最近一年使用:0次
2023-03-05更新
|
438次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
2 . 铝的卤化物AlX3(X=Cl、Br、I)气态时以Al2X6双聚形态存在,下列说法错误的是

| 性质 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/℃ | 1290 | 192.4 | 97.8 | 189.4 |
| 沸点/℃ | 1272 | 180 | 256 | 382 |
| A.AlF3晶体类型与其他三种不同 |
| B.1molAl2Cl6中所含配位键数目为4NA |
| C.Al2X6中Al、X原子价电子层均满足8e-结构 |
| D.AlCl3熔点高于AlBr3原因是Cl的电负性大于Br,具有一定离子晶体特征 |
您最近一年使用:0次
2023-03-03更新
|
1382次组卷
|
9卷引用:黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(普通班)化学试题
黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(普通班)化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(实验班)化学试题山东省淄博市2022-2023学年高三第一次模拟考试化学试题山东省单县第二中学2023届高三下学期第1次 阶段性质量检测化学试题(已下线)专题06 物质结构与性质辽宁省锦州市育明高级中学2022-2023学年高二下学期第一次阶段性考试化学试题辽宁省沈阳市东北育才学校(高中部)2022-2023学年高二下学期4月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高二下学期期中考试化学试题广东省东莞市东莞外国语学校2023-2024学年高二上学期11月期中化学试题
名校
解题方法
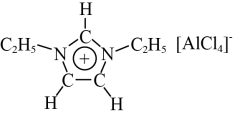
3 . 离子液体是一种全部由离子组成的液体,它具有独特的性能,被广泛应用于化学研究的各个领域中。某离子液体由如图所示正离子和负离子构成。
(1)正离子中各元素的电负性由小到大的顺序为_____ (用元素符号表示);正离子中C原子的杂化方式为______ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为_____ 或_____ 。
(3)正离子中存在的作用力有_____ (填标号)。
a.极性共价键 b.非极性共价键 c.氢键 d.离子键
(4)基态Cl原子的价层电子的轨道表示式为_____ 。
(5)负离子的空间结构为_____ 形。
(6)分子中的大π键可用符号π 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(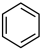 )中的大π键可表示为π
)中的大π键可表示为π 。则正离子中的大π键可表示为
。则正离子中的大π键可表示为_____ 。
(1)正离子中各元素的电负性由小到大的顺序为
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为(3)正离子中存在的作用力有
a.极性共价键 b.非极性共价键 c.氢键 d.离子键
(4)基态Cl原子的价层电子的轨道表示式为
(5)负离子的空间结构为
(6)分子中的大π键可用符号π
 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯( )中的大π键可表示为π
)中的大π键可表示为π 。则正离子中的大π键可表示为
。则正离子中的大π键可表示为
您最近一年使用:0次
2023-02-28更新
|
315次组卷
|
3卷引用:综合01 物质结构与性质压轴40题-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
4 . 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
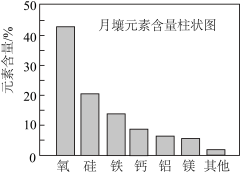
| A.原子半径:Al<Si | B.第一电离能:Mg<Ca |
| C.Fe位于元素周期表的p区 | D.这六种元素中,电负性最大的是O |
您最近一年使用:0次
2023-02-23更新
|
4105次组卷
|
18卷引用:黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二下学期7月期末考试化学试题
黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二下学期7月期末考试化学试题天津市南开区2022-2023学年高二上学期阶段性质量监测化学试题2022年天津市普通高中学业水平等级性考试化学试题2022年天津高考化学真题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(选择题1-4)(已下线)专题07 突破原子结构和元素周期表(律)(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)天津市第二南开学校2022--2023学年高二下学期期中质量调查化学试题(已下线)第19讲元素周期律与元素周期表(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题1-5天津市北辰区2023-2024学年高三上学期11月期中考试化学试题(已下线)专题11 原子结构 原子结构与元素的性质-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)湖南省长沙市明德中学2023-2024学年高二上学期12月月考化学试题浙江省宁波市奉化区2023-2024学年高二上学期期末检测化学试题(已下线)热点02 原子结构与元素的性质广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)
名校
5 . 某化合物可用作发酵助剂,结构如图所示。图中X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,其中Y为地壳中含量最高的元素。下列有关说法不正确的是
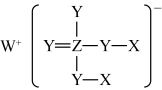
| A.工业上常用电解法制备元素W的单质 |
| B.Z的最高价氧化物的水化物的酸性比硫酸弱 |
| C.X分别与Y、Z、W形成的简单化合物中均含有共价键 |
| D.四种元素中电负性最大的是Y,第一电离能最小的是W |
您最近一年使用:0次
2023-02-18更新
|
452次组卷
|
5卷引用:黑龙江省哈尔滨市第四中学校2022-2023学年高二下学期4月月考化学试题
名校
6 . 下列说法正确的是
| A.Cl、Br、Se(硒)的电负性依次减小 |
| B.硼原子核外电子由1s22s22p1→1s22s12p2,原子放出能量 |
| C.C、N、O三种元素第一电离能从大到小的顺序是O>N>C |
| D.基态某原子的价层电子排布式为4d105s1,推断该元素位于第五周期第IA族 |
您最近一年使用:0次
2023-02-09更新
|
302次组卷
|
4卷引用:黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题
名校
解题方法
7 . 法匹拉韦是治疗新冠肺炎的一种药物,其结构如图所示。下列说法错误的是


| A.该分子中所含元素中电负性最小的是H |
| B.该分子中C﹣F键的键能大于C﹣N键的键能 |
| C.该分子中所有C原子都为sp2杂化 |
| D.该分子中σ键与π键数目之比为7:2 |
您最近一年使用:0次
2023-01-13更新
|
587次组卷
|
5卷引用:黑龙江省齐齐哈尔市第八中学校2022-2023学年高二下学期4月月考化学试题
名校
8 . 解释下列现象的原因不正确的是
| 选项 | 现象 | 原因 |
| A | AlCl3中含有共价键 | Al与C1元素间的电负性差值小于1.7 |
| B | HF的稳定性强于HCl | HF分子之间除了范德华力以外还存在氢键 |
| C | 对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高 | 对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键 |
| D | 碘在CCl4中的溶解度比在水中大 | 碘和CCl4均为非极性分子,水是极性分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-13更新
|
243次组卷
|
4卷引用:黑龙江省齐齐哈尔市第八中学校2022-2023学年高二下学期4月月考化学试题
9 . 对于第三周期元素的有关叙述错误的是
| A.碱性:NaOH > Mg(OH)2> Al(OH)3 | B.电负性:Si< P < S |
| C.第一电离能:Na < Mg < Al | D.Cl-核外电子排布式:1s22s22p63s23p6 |
您最近一年使用:0次
10 . 下列事实的解释不正确 的是
| 事实 | 解释 | |
| A | 气态 再失去一个电子比气态 再失去一个电子比气态 再失去一个电子更难 再失去一个电子更难 |  的价层电子排布为 的价层电子排布为 , , 轨道为半充满比较稳定; 轨道为半充满比较稳定; 的价层电子排布为 的价层电子排布为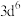 ,再失去一个电子可达到 ,再失去一个电子可达到 轨道半充满的比较稳定状态 轨道半充满的比较稳定状态 |
| B |  中H-O-H键角比 中H-O-H键角比 中的大 中的大 |  的中心原子的孤电子对数为1, 的中心原子的孤电子对数为1, 的中心原子的孤电子对数为2,孤电子对之间的斥力<孤电子对与成键电子对之间的斥力<成键电子对之间的斥力 的中心原子的孤电子对数为2,孤电子对之间的斥力<孤电子对与成键电子对之间的斥力<成键电子对之间的斥力 |
| C | 晶体熔点: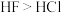 |  分子间能形成氢键 分子间能形成氢键 |
| D | 酸性: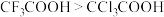 | 氟的电负性大于氯的电负性, 的极性大于 的极性大于 的极性,使 的极性,使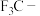 的极性大于 的极性大于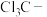 的极性,导致 的极性,导致 的羧基中的羟基的极性更大,更易电离出 的羧基中的羟基的极性更大,更易电离出 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-05更新
|
1463次组卷
|
10卷引用:黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题
黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题北京市石景山区2022-2023学年高三上学期期末考试化学试题北京师范大学附属实验中学2022-2023学年高二下学期3月月考化学试题广东省揭阳市惠来县第一中学2022-2023学年高二下学期第一次月考化学试题山西省孝义市2022-2023学年高二4月月考化学试卷广东省东莞市东华高级中学2022-2023学年高二下学期3月月考化学试题广东省深圳外国语学校2022-2023学年高二下学期3月月考化学试题北京市第一七一中学2023-2024学年高三上学期10月考化学试题湖北省武昌实验中学2023-2024学年高三上学期12月月考化学试题(已下线)选择题6-10



