名校
解题方法
1 . 酚试纸MBTH可用来检测甲醛,涉及的反应如图所示,下列说法正确的是
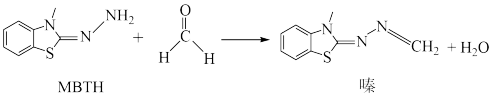
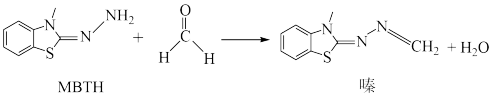
| A.MBTH中元素的电负性:C>N>H | B.“嗪”中的C原子均为 杂化 杂化 |
| C.甲醛的VSEPR模型为四面体形 | D.“嗪”中存在 键和π键 键和π键 |
您最近一年使用:0次
2023-06-08更新
|
65次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
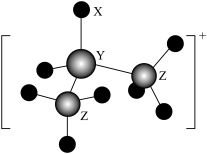
2 . 某离子化合物中的阳离子结构模型如图。已知X、Y、Z为原子序数依次增大的短周期元素,Z的核外成对电子数和未成对电子数之比为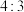 。下列说法错误的是
。下列说法错误的是
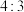 。下列说法错误的是
。下列说法错误的是
| A.X、Y、Z原子的电负性大小为Z>X>Y |
| B.1mol该阳离子所含的配位键数为2NA(NA为阿伏加德罗常数的值) |
| C.该阳离子可与水中的氢原子形成氢键 |
| D.X分别能与Y、Z形成正四面体形的离子 |
您最近一年使用:0次
2023-05-07更新
|
776次组卷
|
4卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题
江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题湖南省长沙市长郡中学2022-2023学年高三模拟试卷(一)化学试题(已下线)考点巩固卷05 物质结构 元素周期律(2大考点50题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)
解题方法
3 . 有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。A、B、C、D、E五种元素的电负性分别为2.1,3.5,1.5,2.5,0.8,请回答下列问题:
(1)A是_______ ,B是_______ ,C是_______ ,D是_______ ,E是_______ (用化学符号填空,下同)。
(2)由电负性判断,以上五种元素中金属性最强的是_______ ,非金属性最强的是_______ 。
(3)当B与A、C、D分别形成化合物时,B显_______ 价(填“正”或“负”或“零”,下同),其他元素显_______ 价。
(4)当B与A、C、D、E(与E形成E2B)分别形成化合物时,化合物中有离子键的是_______ (填化学式)。
(1)A是
(2)由电负性判断,以上五种元素中金属性最强的是
(3)当B与A、C、D分别形成化合物时,B显
(4)当B与A、C、D、E(与E形成E2B)分别形成化合物时,化合物中有离子键的是
您最近一年使用:0次
2022高三·全国·专题练习
4 . 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是
| A.X能与多种元素形成共价键 | B.简单氢化物沸点: |
C.第一电离能: | D.电负性: |
您最近一年使用:0次
2022-07-06更新
|
9644次组卷
|
33卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题
江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题06 物质结构元素周期律-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(1-10)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京清华附中2022-2023学年高三上学期10月统练(三)化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题1-5)(已下线)题型9 元素“位—构-性”关系的综合应用-高考必备50个题型(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用) 天津市静海区第一中学2023-2024学年高三上学期12月月考化学试题天津市和平区2023-2024学年高三下学期第一次质量调查化学试卷湖南省浏阳景雅高级中学2024届高三下学期5月全真仿真模拟考试化学试题吉林省长春外国语学校2021-2022学年高二下学期期末考试化学试题吉林省长春市第五中学2022-2023学年高二上学期期末考试化学试题河南省鹤壁市高中2022-2023学年高二下学期第一次段考化学试题天津市和平区2022-2023学年高二下学期期末质量调查化学试题天津市第一中学2022-2023学年高二上学期期末考试化学试题河北省遵化市第一中学2023-2024学年高二上学期月考2化学试题吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)天津市第五十五中学2023-2024学年高二下学期期中学情调研化学试卷河北省石家庄市第一中学2023-2024学年高二下学期5月月考化学试题
5 . 某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Z的最外层电子数等于W的核外电子数。下列叙述正确的是
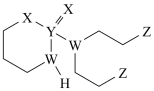

| A.W位于第二周期IIIA族 |
| B.基态Y原子只有1个未成对电子 |
| C.W、Z的最简单氢化物混合物的沸点,前者小于后者 |
| D.电负性:W>Y |
您最近一年使用:0次
2022-06-03更新
|
192次组卷
|
2卷引用:江西省丰城中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
6 . 已知P4单质、次磷酸的结构如图,P4在KOH溶液中的变化是: P4+3KOH+3H2O═3KH2PO2+PH3↑,下列说法正确的是
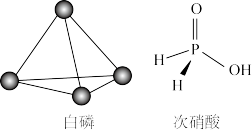

| A.PH3分子中所有的原子可能共平面 |
| B.31 g P4含有1.5NA个P﹣P |
| C.元素的电负性大小顺序:P>O>H>K |
| D.KH2PO2属于酸式盐 |
您最近一年使用:0次
2022-04-29更新
|
119次组卷
|
4卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期开学考化学试题
名校
解题方法
7 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____ 区元素,其基态原子的价电子排布式为_____ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为____ ,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____ (用元素符号表示)。
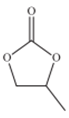
(4)CO32-的几何构型为______ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________ ,1mol碳酸丙烯酯中键的数目为________ .
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____ ,该配离子包含的作用力为__ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______ ,该晶胞的密度为ρg/cm3,阿伏伽德罗常数的值为NA,则Na与O之间的最短距离为_____ cm(用含ρ、NA的代数式表示)。
回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为
(4)CO32-的几何构型为

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
2018-04-27更新
|
459次组卷
|
5卷引用:【市级联考】江西省宜春市2019届高三上学期期末统考理科综合化学试题
名校
解题方法
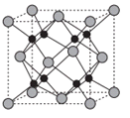
8 . 图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________ 。
(2)ABC的第一电离能由大到小的顺序______________ (用元素符号表示)。
(3)B元素单质分子中的_______ 个π键,与其互为等电子体的阴离子为____________________ 。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________ 杂化,每个分子周围有_____ 个分子与之距离相等且最近。若晶胞棱长为a pm,则该晶体密度的表达式为________ g·cm-3。
(5)G元素的氢化物分子的空间构型为________ ,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同__________ ?(填“相同”或“不同”)。

试回答下列问题:
(1)F元素基态原子的核外电子排布式为
(2)ABC的第一电离能由大到小的顺序
(3)B元素单质分子中的
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用
(5)G元素的氢化物分子的空间构型为
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同
您最近一年使用:0次



