名校
解题方法
1 . 对Na、Mg、Al的有关性质的叙述正确的是:
| A.碱性:NaOH< Mg(OH)2< Al(OH)3 | B.第一电离能:Na< Mg <Al |
| C.还原性:Na> Mg >Al | D.电负性:Na> Mg >Al |
您最近一年使用:0次
2020-11-12更新
|
566次组卷
|
63卷引用:2016-2017学年四川省阆中中学高二上教学质检化学试卷
2016-2017学年四川省阆中中学高二上教学质检化学试卷四川省平昌县驷马中学2020-2021学年高二上学期九月月考化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题四川省乐山市沫若中学2022-2023学年高二上学期第一次月考化学试题(已下线)09—10年泰州中学高二下学期期末考试化学卷(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015宁夏银川市唐徕回民中学高二下学期3月月考化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2014-2015学年吉林省汪清县第六中学高二下学期期末考试化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年宁夏六盘山中学高二下第一次月考化学卷2015-2016学年山西太原五中高二下3月第二次周练化学卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年吉林东北师大附属实验高二下期末化学试卷2015-2016学年吉林梅河口五中高二下期末化学试卷2015-2016吉林东北师大附属实验学校净月实验学校高二下期末化学卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷安徽省蚌埠市第二中学2016-2017学年高二下学期期中考试化学试题河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题河北省深州中学2016-2017学年高二下学期期末考试化学试题内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题福建省福州三中2017-2018学年高二上学期期末考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期期末考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷吉林省长春市第二十九中学2019-2020学年高二上学期期末考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题河南省宏力学校2018-2019学年高二下学期期中考试化学试题内蒙古集宁新世纪中学2020-2021学年高二下学期期末考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 福建省永春美岭中学2021-2022学年高二下学期期中测试化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题
解题方法
2 . 氰化钾是一种剧毒的物质,贮存和使用时必须注意安全。已知:KCN+H2O2=KOCN+H2O,回答下列问题:
(1)OCN-中所含三种元素的第一电离能从大到小的顺序为_________ (用元素符号表示,下同),电负性从大到小的顺序为__________ ,基态氮原子价电子排布图为__________________ 。
(2)H2O2中的共价键类型为_____ (填“σ键”或“π键”),其中氧原子的杂化轨道类型为__________ ;分子中4个原子______ (填“在”或“不在”)同一条直线下。
(1)OCN-中所含三种元素的第一电离能从大到小的顺序为
(2)H2O2中的共价键类型为
您最近一年使用:0次
名校
解题方法
3 . 卤族元素能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线(图1)表示卤族元素某种性质随核电荷数的变化趋势。正确的是___ 。
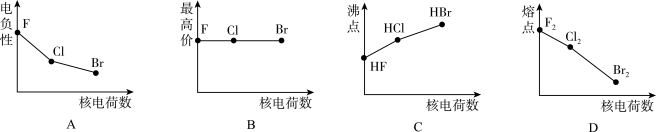
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为___ 。
(3)F2与其他卤素单质反应可以生成ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=−313kJ/mol;F−F键的键能为159kJ/mol;Cl−C1键的键能为242kJ/mol;则ClF3中C1−F键的平均键能为___ kJ/mol。ClF3的熔、沸点比BrF3的___ (填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___ 。
(5)(CN)2与Cl2的化学性质相似,(CN)2与NaOH溶液反应的化学方程式为___ 。
(6)上述反应涉及到的元素中,氯原子核外电子能量最高能级符号是___ ;H、Cl、N、O、Na的电负性从小到大的顺序为___ 。
(7)氯有多种含氧酸,其酸性:HClO4>HClO3>HClO2>HClO,从物质结构的角度解释以上含氧酸酸性依次减小的原因___ 。
(1)下面曲线(图1)表示卤族元素某种性质随核电荷数的变化趋势。正确的是

(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为
(3)F2与其他卤素单质反应可以生成ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=−313kJ/mol;F−F键的键能为159kJ/mol;Cl−C1键的键能为242kJ/mol;则ClF3中C1−F键的平均键能为
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(5)(CN)2与Cl2的化学性质相似,(CN)2与NaOH溶液反应的化学方程式为
(6)上述反应涉及到的元素中,氯原子核外电子能量最高能级符号是
(7)氯有多种含氧酸,其酸性:HClO4>HClO3>HClO2>HClO,从物质结构的角度解释以上含氧酸酸性依次减小的原因
您最近一年使用:0次
2020-10-23更新
|
173次组卷
|
2卷引用:四川省遂宁市射洪中学校2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
4 . 如图为酞菁钴分子的结构简式。下列说法不正确的是


| A.电负性:N>C>H | B.4个N原子均与Co形成配位键 |
| C.分子中C的杂化轨道类型为sp2 | D.结构中存在σ键、π键和大π键 |
您最近一年使用:0次
2020-10-10更新
|
195次组卷
|
2卷引用:四川省内江市威远中学校2021-2022学年高二上学期期中考试化学试题
5 . 钒(V)固氮酶种类众多,其中种结构如图所示:

(1)基态钒原子的核外电子排布式为________ ,该元素位于元素周期表的第___ 族。
(2)钒固氮酶中钒的配位原子有___ (写元素符号)。
(3)配体CH3CN中碳的杂化类型为____ 所含σ键与π键数目之比为___ 。
(4)配体CH3CN中所涉及元素的电负性由强到弱依次排序为__________ (用元素符号表示)。
(5)写出证明非金属性Cl >S的一个常见离子方程式:__________ 。

(1)基态钒原子的核外电子排布式为
(2)钒固氮酶中钒的配位原子有
(3)配体CH3CN中碳的杂化类型为
(4)配体CH3CN中所涉及元素的电负性由强到弱依次排序为
(5)写出证明非金属性Cl >S的一个常见离子方程式:
您最近一年使用:0次
2020-09-04更新
|
226次组卷
|
2卷引用:四川省成都市简阳市阳安中学2020-2021学年高二上学期11月月考化学试题
名校
解题方法
6 . 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是( )
| A | ||
| D | B | E |
| C |
| A.D、B、E三种元素的第一电离能逐渐减小 |
| B.电负性:E>C |
| C.D、B、E三种元素形成的简单离子的半径逐渐增大 |
| D.气态氢化物的稳定性顺序:D>B>E |
您最近一年使用:0次
2020-06-09更新
|
342次组卷
|
9卷引用:四川省西充中学 2021-2022 学年高二上学期期中考试化学试题
四川省西充中学 2021-2022 学年高二上学期期中考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题2.2.2元素第一电离能和电负性的周期性变化 课后湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
解题方法
7 . 下表为长式周期表的一部分其中的编号代表对应的元素.
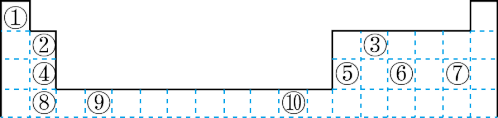
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为____________ ,其中元素③的基态原子轨道表达式为___________ ;①和⑥形成的一种常见四原子分子的化学式为___________ ,它是 _________________ (填“极性”、“非极性”)分子。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程________________________ 。
(6)上表中元素⑤的氢氧化物为两性氢氧化物,请写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式:_______________________________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
(6)上表中元素⑤的氢氧化物为两性氢氧化物,请写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式:
您最近一年使用:0次
名校
8 . 下列说法正确的是( )
| A.元素原子的最外层电子数等于元素的最高正化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.S、Cl的电负性和单质的氧化性均依次增强 |
| D.元素周期表中位于金属元素和非金属元素分界线附近的元素属于过渡元素 |
您最近一年使用:0次
2020-03-26更新
|
93次组卷
|
4卷引用:2016-2017学年四川省三台中学校高二上月考化学试卷
名校
解题方法
9 . 下列叙述正确的是
| A.铬原子的电子排布式:ls22s22p63s23p63d44s2 |
| B.Na、Mg、Al的第一电离能逐渐增大 |
C.碳原子的电子排布图: |
| D.N、O、F的电负性逐渐增大 |
您最近一年使用:0次
2019-06-28更新
|
848次组卷
|
15卷引用:四川省越西中学2019-2020学年高二5月月考化学试题
四川省越西中学2019-2020学年高二5月月考化学试题福建省泉州市泉港区第一中学2017-2018学年高二下学期第一次(4月)月考化学试题【全国百强校】河北省武邑中学2017-2018学年高二下学期期中考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题人教化学选修3第一章第二节课时5山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题辽宁省锦州市黑山县黑山中学2019-2020学年高二下学期线上教学检测化学试题安徽省亳州市涡阳县第九中学2019-2020学年高二7月月考化学试题河南省驻马店市2018-2019学年高二上学期期末考试化学试题江苏省镇江市吕叔湘中学2019-2020学年高二下学期4月诊断考试化学试题福建省南安市柳城中学2020-2021学年高二下学期期中考试化学试题黑龙江省黑河市第九中学2022-2023学年高三上学期摸底考试化学试题新疆疏勒县实验学校2021-2022学年高二下学期期中考试化学试题黑龙江省大庆市大庆中学2022-2023学年高三第二次模拟考试化学试题
名校
10 . 关于如图结构的说法不正确的是( )
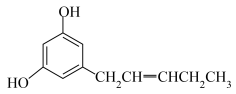

A.分子中既有 键又有π键 键又有π键 |
| B.碳原子有sp、sp2、sp3三种杂化方式 |
| C.O—H键的极性强于C-H键的极性 |
| D.羟基中氧原子采取sp3杂化,VSEPR模型为四面体形 |
您最近一年使用:0次
2019-06-26更新
|
695次组卷
|
8卷引用:四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题



