2021高三·全国·专题练习
解题方法
1 . 某些金属与非金属原子间能形成共价键。(___________)
您最近一年使用:0次
2021-10-21更新
|
731次组卷
|
7卷引用:考点06 原子结构 化学键-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点06 原子结构 化学键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题17 化学键(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)【知识图鉴】单元讲练测必修第一册第四单元01讲核心1.3.2元素的电离能、电负性及其变化规律(课中)-鲁科版选择性必修2
2021高三·全国·专题练习
解题方法
2 . 下列说法正确的是
| A.金属与非金属化合时,都可以形成离子键 |
| B.金属元素的电负性一定小于非金属元素的电负性 |
| C.电负性相差越大的元素间越容易形成离子键 |
| D.同周期元素从左到右,第一电离能和电负性均增大 |
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
3 . 回答下列问题:
(1)苯胺( NH2 )的晶体类型是
NH2 )的晶体类型是___________ 。苯胺与甲苯( CH3)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
CH3)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________ 。
(2)NH4H2PO4中,电负性最高的元素是___________ ;P的___________ 杂化轨道与O的2p轨道形成___________ 键。
(3)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为___________ (用n代表P原子数)。
(1)苯胺(
 NH2 )的晶体类型是
NH2 )的晶体类型是 CH3)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
CH3)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是(2)NH4H2PO4中,电负性最高的元素是
(3)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为
您最近一年使用:0次
名校
解题方法
4 . 下面关于四种微粒的比较正确的是
①基态原子的电子排布式: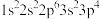 ;②价电子排布式:
;②价电子排布式: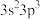 ;③2p轨道为半充满的原子;④原子的2p轨道上只有两对成对电子
;③2p轨道为半充满的原子;④原子的2p轨道上只有两对成对电子
①基态原子的电子排布式:
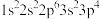 ;②价电子排布式:
;②价电子排布式: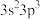 ;③2p轨道为半充满的原子;④原子的2p轨道上只有两对成对电子
;③2p轨道为半充满的原子;④原子的2p轨道上只有两对成对电子| A.原子半径:②>①>③>④ |
| B.最高正化合价:④>①>③=② |
| C.电负性:④>③>②>① |
| D.第一电离能:④>③>①>② |
您最近一年使用:0次
2021-07-04更新
|
493次组卷
|
8卷引用:第36讲 原子结构与性质(精讲)-2022年一轮复习讲练测
(已下线)第36讲 原子结构与性质(精讲)-2022年一轮复习讲练测湖北省新高考联考协作体2020-2021高二下学期期末考试化学试题湖北省孝感市云梦县黄香高级中学2021-2022学年高二上学期期末考试化学试题天津市新四区示范校2022-2023学年高二下学期期末联考化学试题四川省德阳外国语学校2023-2024学年高二下学期期中考试化学试题(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)辽宁省沈阳市东北育才学校双语校区2023-2024学年高二下学期期中考试化学试题
5 . 我国古代炼丹家在炼制丹药过程中发明了火药,涉及的主要反应为:S+2KNO3+3C K2S+N2↑+3CO2↑。下列有关说法正确的是
K2S+N2↑+3CO2↑。下列有关说法正确的是
 K2S+N2↑+3CO2↑。下列有关说法正确的是
K2S+N2↑+3CO2↑。下列有关说法正确的是| A.单质S是共价晶体 |
| B.第一电离能:N>O>K |
| C.电负性:N>O>S |
D.基态碳原子核外价电子的轨道表示式为 |
您最近一年使用:0次
2021-07-01更新
|
281次组卷
|
3卷引用:第36讲 原子结构与性质(精讲)-2022年一轮复习讲练测
(已下线)第36讲 原子结构与性质(精讲)-2022年一轮复习讲练测江苏省常州市教育学会2020-2021学年高二下学期期末学业水平监测化学试题湖北省黄冈市蕲春县第四高级中学2021-2022学年上学期高三11月月考化学试题
解题方法
6 . 五种主族元素在周期表中的位置如图所示。L的单质在常温常压下呈液态,且保存时需要用水液封。下列推断正确的是
| X | Y | Z | T | |
| L |
| A.原子半径:X<Y<Z<T<L |
| B.气态氢化物的还原性:L>Z>T |
| C.X的电负性是五种元素中最小的 |
| D.Y和T组成的化合物是离子化合物 |
您最近一年使用:0次
名校
7 . 优氯净(C3N3O3Cl2Na)是常用的杀菌消毒剂。下列有关优氯净组成元素说法正确的是
| A.电负性:χ(O)>χ(N)>χ(C) | B.原子半径:r(Cl)>r(Na)>r(O) |
| C.O在周期表中的位置:第2周期IVA族 | D.简单气态氢化物的热稳定性:NH3>H2O |
您最近一年使用:0次
2021-05-10更新
|
380次组卷
|
3卷引用:第36讲 原子结构与性质(精练)-2022年一轮复习讲练测
名校
解题方法
8 . 在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。下列说法错误的是
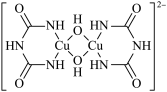

| A.该配离子与水分子形成氢键的原子只有N和O |
| B.该配离子中铜离子的配位数是4 |
| C.基态Cu原子的价电子排布式是 3d104s1 |
| D.该配离子中非金属元素的电负性大小顺序为O>N>C>H |
您最近一年使用:0次
2021-04-29更新
|
915次组卷
|
19卷引用:解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练湖北省2021年普通高中学业水平选择考适应性测试化学试题河北省石家庄市第二中学2021届高三3月学情考试化学试题湖北武汉市蔡甸区汉阳一中2020-2021学年高二下学期3月月考化学试题辽宁省实验中学东戴河分校两校2020-2021学年高二4月联考化学试题四川省成都市树德中学2020-2021学年高二下学期4月月考化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)山东省滨州市无棣县2020-2021学年高二下学期期中考试化学试题河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题福建省连城县第一中学2021-2022学年高三上学期10月月考化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)专题十 物质结构与性质(选择性必修2)能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第7讲 配合物与超分子浙江金华第一中学2021-2022学年高二下学期期中考试化学试题第三章 本章达标检测2北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题江西省景德镇一中2022-2023学年高二上学期期中考试化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题
9 . 秦兵马俑展现了我国古代科技文化的伟大成就。近年来人们研究发现秦俑彩绘所用的原料的主要成分为BaCuSi2O6,含有微量硫元素等。回答下列问题:
(1)原子轨道是指电子在原子核外的___________ 。Cu原子核外电子占据最高能级的符号是___________ ,Cu原子核外最外层电子的电子云轮廓图形状为___________ 。
(2)硫化硅为白色晶体,分子式为SiS2,遇水分解为SiO2及H2S气体,分解反应中所涉及的
所有元素的电负性由大到小的顺序为___________ (填元素符号);SiS2的结构与CS2类似,则SiS2分子的空间构型为___________ 。
(3)一种含Cu、S元素的有机物的结构简式如图1所示,该有机物中存在的作用力类型有_______ (填标号),N原子的杂化方式为___________ 。
a.极性键 b.离子键 c.非极性键 d.配位键 e.金属键

(4)TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2−均与Ti4+、Ba2+相接触),已知O2−的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为___________ pm、_____ pm。
(1)原子轨道是指电子在原子核外的
(2)硫化硅为白色晶体,分子式为SiS2,遇水分解为SiO2及H2S气体,分解反应中所涉及的
所有元素的电负性由大到小的顺序为
(3)一种含Cu、S元素的有机物的结构简式如图1所示,该有机物中存在的作用力类型有
a.极性键 b.离子键 c.非极性键 d.配位键 e.金属键

(4)TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2−均与Ti4+、Ba2+相接触),已知O2−的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为
您最近一年使用:0次
解题方法
10 . Ni、Cu能形成多种化合物,比如Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
(1)Ni基态原子核外电子排布式为______ ;1 mol Ni(CO)4含σ键数目为______ 。
(2)NiCl2·6H2O在SOCl2气流中加热时,生成NiCl2和两种酸性气体,写出该反应的化学方程式:______
(3)[Cu(NH3)4]SO4中的非金属元素H、N、O的电负性由大到小的顺序为______ (用元素符号回答);[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键为______ ,提供孤电子对的成键原子是______ 。
(4)某白铜合金晶胞结构如图所示,晶胞中铜原子与镍原子的个数比为______ 。
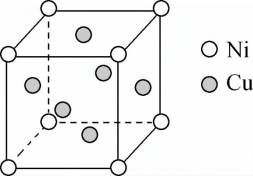
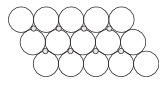
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2−作密置单层排列,Ni2+填充其中。已知O2-的半径为a m,阿伏加德罗常数的值为NA,则每平方米上分散的该晶体的质量为______ g。(写出表达式即可。图中大白球表示O2− ,小黑球表示Ni2+)
(1)Ni基态原子核外电子排布式为
(2)NiCl2·6H2O在SOCl2气流中加热时,生成NiCl2和两种酸性气体,写出该反应的化学方程式:
(3)[Cu(NH3)4]SO4中的非金属元素H、N、O的电负性由大到小的顺序为
(4)某白铜合金晶胞结构如图所示,晶胞中铜原子与镍原子的个数比为

(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2−作密置单层排列,Ni2+填充其中。已知O2-的半径为a m,阿伏加德罗常数的值为NA,则每平方米上分散的该晶体的质量为

您最近一年使用:0次



