解题方法
1 . 氮元素形成的化合物种类众多,用途广泛。根据信息回答下列问题。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为________________ 。
②上述涉及的元素H、B 、C、N、O中电负性最大的是_____ (填元素符号)。
(2)BF3、NH3和PH3分子中键角由大到小的顺序为_____ 。
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=__________________ 。
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:
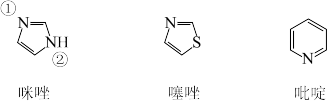
①上述三种物质中,沸点最高的是_____ (填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为_____________ 。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是_____ (填“①”或“②” )号氮原子。
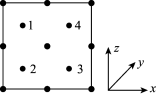
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为________ 。
(6)某铁氮化合物晶体的晶胞结构如图所示。
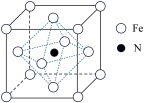
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_____ 。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g·cm-3(列出计算式即可)。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为
②上述涉及的元素H、B 、C、N、O中电负性最大的是
(2)BF3、NH3和PH3分子中键角由大到小的顺序为
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:

①上述三种物质中,沸点最高的是
②吡啶中氮原子的杂化轨道的空间构型为
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(
 ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为
(6)某铁氮化合物晶体的晶胞结构如图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
2 . 生产、生活和科技发展离不开化学。请回答下列问题:
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
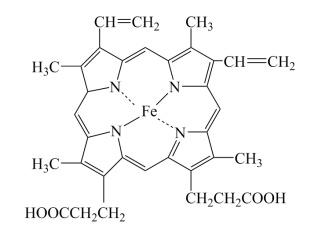
①基态Fe原子的价电子排布图为___________ ,Fe2+核外电子有___________ 种空间运动状态。
②血红素中各非金属元素的电负性由小到大的顺序为___________ 。
③Fe2+与邻二氮菲(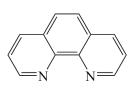 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:___________ ;若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
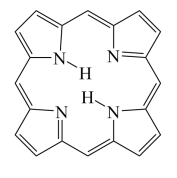
④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取___________ 杂化。
(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的___________ 区,找出距离As(0.25,0.25,0.25)最近的As___________ (用分数坐标表示)。
②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为___________ pm(列出计算式)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①基态Fe原子的价电子排布图为
②血红素中各非金属元素的电负性由小到大的顺序为
③Fe2+与邻二氮菲(
 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取

(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的

②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为
您最近一年使用:0次
2023-03-14更新
|
1068次组卷
|
2卷引用:四川省成都市第七中学2023届高三下学期二诊模拟考试理科综合化学试题
3 . 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。
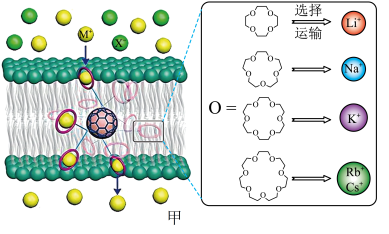
已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。观察图甲,冠醚不能识别和运输X-的主要原因可能是___________ 。
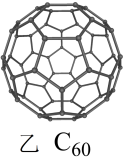
(4)足球烯的结构如图乙所示。1mol足球烯含___________ molσ键。
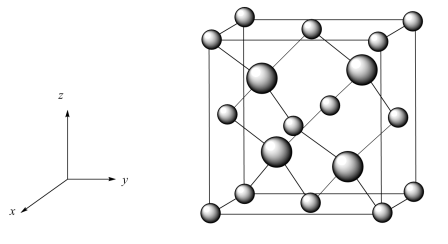
(5)铷晶胞为体心立方堆积,如图丙所示。
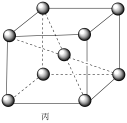
铷晶胞的原子空间利用率为___________ (用含π的式子表示)。
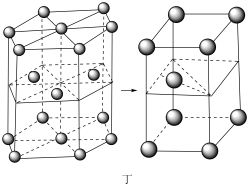
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为___________ g· cm-3(用含字母的式子表示)。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚-5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| ___________ | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)足球烯的结构如图乙所示。1mol足球烯含

(5)铷晶胞为体心立方堆积,如图丙所示。

铷晶胞的原子空间利用率为
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为

您最近一年使用:0次
解题方法
4 . 如图甲,铜离子与有机物HA可形成一种螯合物 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
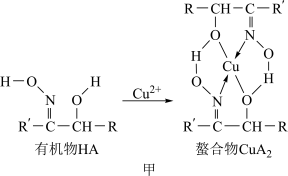
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+ CuA2+2H+
CuA2+2H+
回答下列问题:
(1)基态铜原子的价电子排布式为_______ 。
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是_______ 。
(3)螯合物 中的氮原子杂化方式为
中的氮原子杂化方式为_______ ,氧原子的杂化方式为_______ 。
(4)下列关于螯合物 的说法中,正确的是
的说法中,正确的是_______ (填序号)。
① 中O的配位能力比N强
中O的配位能力比N强
②与 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型
③ 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂
④每个 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键
(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是_______ 。
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数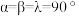 ,
, ,
,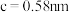 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
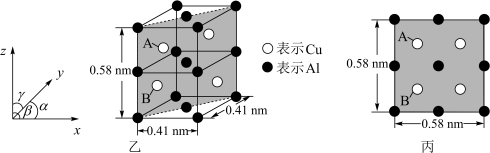
该晶体的化学式为_______ ,密度为_______  (结果保留两位有效数字)。
(结果保留两位有效数字)。
 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+
 CuA2+2H+
CuA2+2H+回答下列问题:
(1)基态铜原子的价电子排布式为
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是
(3)螯合物
 中的氮原子杂化方式为
中的氮原子杂化方式为(4)下列关于螯合物
 的说法中,正确的是
的说法中,正确的是①
 中O的配位能力比N强
中O的配位能力比N强②与
 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型③
 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂④每个
 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数
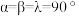 ,
, ,
,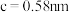 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
该晶体的化学式为
 (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物,可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
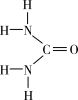
(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是______________ 。
(2)尿素中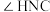
______________ 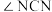 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是______________ 。
(3)[Fe(H2NCONH2)6](NO3)3中不存在 的化学键____________ (填序号)。
A.离子键 B.金属键 C.配位键 D. 键 E.
键 E. 键
键
Ⅱ.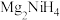 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。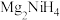 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4) 原子的价电子排布式为
原子的价电子排布式为______________ 。
(5) 位于
位于 原子形成的
原子形成的______________ (填“八面体空隙”或“四面体空隙”)。
(6)该晶体的密度为___________  (用含a、
(用含a、 代数式表示)。
代数式表示)。

(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是
(2)尿素中
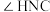
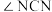 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是(3)[Fe(H2NCONH2)6](NO3)3中
A.离子键 B.金属键 C.配位键 D.
 键 E.
键 E. 键
键Ⅱ.
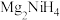 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。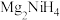 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4)
 原子的价电子排布式为
原子的价电子排布式为(5)
 位于
位于 原子形成的
原子形成的(6)该晶体的密度为
 (用含a、
(用含a、 代数式表示)。
代数式表示)。
您最近一年使用:0次
名校
解题方法
6 . 二甲基亚砜(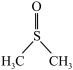 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
(1)铬和锰基态原子核外未成对电子数之比为_______ 。
(2)已知:二甲基亚砜能够与水和丙酮(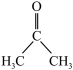 )分别以任意比互溶。
)分别以任意比互溶。
①二甲基亚砜分子中硫原子的杂化类型为_______ 。
②丙酮分子中各原子电负性由大到小的顺序为_______ 。
③二甲基亚砜易溶于水,原因可能为_______ 。
(3)CrCl3·6H2O的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3:2:1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为_______ 。
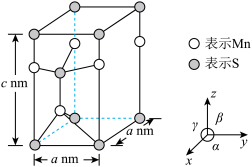
(4)已知硫化锰(MnS)晶胞如图所示,该晶胞参数α=120°,β=γ=90°。
①该晶体中,锰原子周围的硫原子数目为_______ 。
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别r1 nm和r2 nm,该晶体中原子的空间利用率为_______ (列出计算式即可)。
 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:(1)铬和锰基态原子核外未成对电子数之比为
(2)已知:二甲基亚砜能够与水和丙酮(
 )分别以任意比互溶。
)分别以任意比互溶。①二甲基亚砜分子中硫原子的杂化类型为
②丙酮分子中各原子电负性由大到小的顺序为
③二甲基亚砜易溶于水,原因可能为
(3)CrCl3·6H2O的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3:2:1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为
(4)已知硫化锰(MnS)晶胞如图所示,该晶胞参数α=120°,β=γ=90°。
①该晶体中,锰原子周围的硫原子数目为
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别r1 nm和r2 nm,该晶体中原子的空间利用率为

您最近一年使用:0次
2022-10-21更新
|
272次组卷
|
2卷引用:广东省广东实验中学2022-2023学年高三上学期第一次阶段考试化学试题
解题方法
7 . 材料的发展水平始终是时代进步和人类文明的标志。当前含铁的磁性材料在国防、电子信息等领域中具有广泛应用。请回答下列问题:
(1)基态铁原子的价电子排布图为_______ ,基态铁原子核外电子的空间运动状态有_______ 种, 其处在最高能层的电子的电子云形状为_______ 。
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。
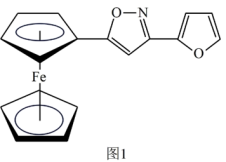
①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为_______ (填序号)。
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为_______ 。
(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。
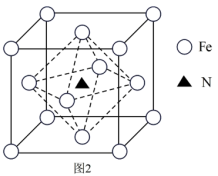
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_______ 。
②该化合物的化学式为_______
(1)基态铁原子的价电子排布图为
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②该化合物的化学式为
您最近一年使用:0次
解题方法
8 . 根据信息回答下列问题:
Ⅰ.元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出10种元素的电负性:
已知:两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
(1)通过分析电负性的变化规律,确定 元素电负性的最小范围
元素电负性的最小范围_______ 。
(2)判断下列物质是离子化合物还是共价化合物:
A. B.
B. C.
C. D.SiC
D.SiC
①属于共价化合物的是_______ (填字母)。
② 易与水反应生成生成一种刺激性气味的气体,写出反应的化学方程式
易与水反应生成生成一种刺激性气味的气体,写出反应的化学方程式_______ 。
(3) 溶液在实验室里可以用来制备
溶液在实验室里可以用来制备 ,写出制备
,写出制备 的离子方程式
的离子方程式_______ 。
Ⅱ.元素原子的第一电离能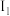 随原子序数呈周期性变化,请回答:
随原子序数呈周期性变化,请回答:
(4) 的第一电离能小于
的第一电离能小于 ,从原子结构的角度解释其原因
,从原子结构的角度解释其原因_______ 。
(5)与 同一周期,第一电离能最大的元素是
同一周期,第一电离能最大的元素是_______ (写名称)。
Ⅰ.元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出10种元素的电负性:
| 元素 |  |  |  | C |  |  |  | N |  | O | H |
| 电负性 | 1.5 | 1.5 | 2.5 | 3.0 | 0.9 | 1.0 | 3.0 | 1.8 | 3.5 | 2.1 |
(1)通过分析电负性的变化规律,确定
 元素电负性的最小范围
元素电负性的最小范围(2)判断下列物质是离子化合物还是共价化合物:
A.
 B.
B. C.
C. D.SiC
D.SiC①属于共价化合物的是
②
 易与水反应生成生成一种刺激性气味的气体,写出反应的化学方程式
易与水反应生成生成一种刺激性气味的气体,写出反应的化学方程式(3)
 溶液在实验室里可以用来制备
溶液在实验室里可以用来制备 ,写出制备
,写出制备 的离子方程式
的离子方程式Ⅱ.元素原子的第一电离能
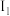 随原子序数呈周期性变化,请回答:
随原子序数呈周期性变化,请回答:(4)
 的第一电离能小于
的第一电离能小于 ,从原子结构的角度解释其原因
,从原子结构的角度解释其原因(5)与
 同一周期,第一电离能最大的元素是
同一周期,第一电离能最大的元素是
您最近一年使用:0次
解题方法
9 . 完成下列问题。
(1)基态铬的核外电子排布式是:_______ ,其在周期表中的位置是_______ 。
(2) 可以形成的一种配合物是
可以形成的一种配合物是 ,
,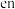 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为_______ ,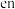 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为_______ 。
(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=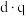 。
。
①请写出一种μ=0的分子_______ 。
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为_______ 。
③治癌药物 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为_______ 。
(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。
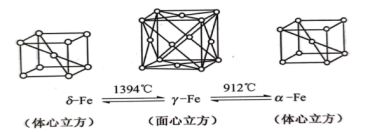
① 晶体中
晶体中 原子的配位数是
原子的配位数是_______ 。
②若 晶胞边长为a,
晶胞边长为a, 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为_______ 。
(1)基态铬的核外电子排布式是:
(2)
 可以形成的一种配合物是
可以形成的一种配合物是 ,
,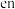 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为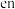 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=
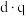 。
。①请写出一种μ=0的分子
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为
③治癌药物
 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。

①
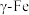 晶体中
晶体中 原子的配位数是
原子的配位数是②若
 晶胞边长为a,
晶胞边长为a,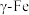 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为
您最近一年使用:0次
解题方法
10 . 我国科学家及其合作团队研究发现,六方相(hcp)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:
(1)基态铁原子最外层电子所在能级的电子云轮廓图为_______ 形。
(2)H、C、O三种元素的电负性由大到小的排序为_______ (填元素符号)。
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释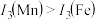 的主要原因:
的主要原因:_______ 。
(4)H、C,O三种元素可以组成很多种物质。
① 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有_______ (填化学式),其中 的立体构型为
的立体构型为_______ 。
②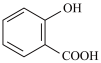 的沸点
的沸点_______ (填“大于”、“小于”或“等于”)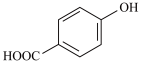 的沸点。
的沸点。
(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
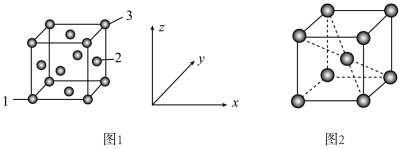
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为_______ 。
②若图2中晶胞参数为apm,设 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为_______ (用含a、 的代数式表示)
的代数式表示) 。
。
(1)基态铁原子最外层电子所在能级的电子云轮廓图为
(2)H、C、O三种元素的电负性由大到小的排序为
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | 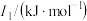 |  |  |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
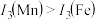 的主要原因:
的主要原因:(4)H、C,O三种元素可以组成很多种物质。
①
 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有 的立体构型为
的立体构型为②
 的沸点
的沸点 的沸点。
的沸点。(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。

①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为
②若图2中晶胞参数为apm,设
 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次



