名校
解题方法
1 . 人体血红蛋白中含有Fe2+一卟啉环配合物,结合O2后,其基本结构如图(烃基略去)。回答下列问题:
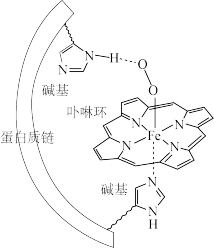
(1)Fe、N、C、H四种元素中电负性最大的是____ (填写元素符号);血红蛋白结合O2前后的中心Fe均为正二价,其基态时3d轨道中电子数为____ 。
(2)卟啉环中所有原子共平面,其中N的杂化方式为____ ,C-Nσ键有____ 个。
(3)图中Fe2+的配位数为__________ ;其中一个碱基通过 ____ 作用与O2分子结合,另一碱基的N原子提供____ 与Fe2+配位。
(4)已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更___ (填“高”或“低”),说明理由____ 。
(5)从298K升温到1200K时,体心立方型的δ -Fe变化为面心立方最密堆积,配位数____ (填“变大”、“不变”或“变小”)。假定升温时Fe原子半径不变,体积变为低温时的___ %(已知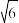 =2.45,结果保留两位有效数字)。
=2.45,结果保留两位有效数字)。

(1)Fe、N、C、H四种元素中电负性最大的是
(2)卟啉环中所有原子共平面,其中N的杂化方式为
(3)图中Fe2+的配位数为
(4)已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更
(5)从298K升温到1200K时,体心立方型的δ -Fe变化为面心立方最密堆积,配位数
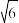 =2.45,结果保留两位有效数字)。
=2.45,结果保留两位有效数字)。
您最近一年使用:0次
2021-04-04更新
|
533次组卷
|
2卷引用:四川省成都市2021届高三第二次诊断性检测理综化学试题
名校
解题方法
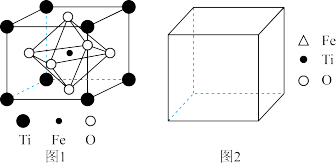
2 . 12月 17日凌晨,嫦娥五号完成“ 挖土” 之旅返回地球。查阅资料,月球玄武岩是构成月球的岩石之一,主要由辉石(主要成分硅酸盐)和钛铁矿(主要成分 FeTiO3)等组成。回答下列问题:
(1)基态铁原子的价电子排布式为:______ 。
(2)与 Fe同周期,且最外层电子数相同的主族元素是______ (填元素符号)。
(3)基态 Ti原子核外电子占据的最高能层符号为______ ;其最外层电子的电子云轮廓图为______ 。
(4)1molFe3[Fe(CN)6]2中含有 σ键数为______ ,[Fe(CN)6]3-中配体为______ ,其中 C原子的杂化轨道类型为______ ,H、C、N、Si四种元素的电负性由大到小的顺序为______ 。
(5)FeTiO3的结构如图 1所示,其中由 O围成的______ (填“ 四面体空隙” 或“ 八面体空隙” )被 Fe占据。在图 2中画出 FeTiO3结构的另一种表示______ (要求:Fe处于晶胞的顶点),Ti的配位数为______ 。
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=______ pm。(列出计算表达式)
(1)基态铁原子的价电子排布式为:
(2)与 Fe同周期,且最外层电子数相同的主族元素是
(3)基态 Ti原子核外电子占据的最高能层符号为
(4)1molFe3[Fe(CN)6]2中含有 σ键数为
(5)FeTiO3的结构如图 1所示,其中由 O围成的
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=

您最近一年使用:0次
2021-03-14更新
|
857次组卷
|
3卷引用:河南省洛阳市2021届高三3月调研考试理综化学试题
河南省洛阳市2021届高三3月调研考试理综化学试题湖南省娄底市第五中学2021-2022学年高三下学期期中考试化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
解题方法
3 . 草酸铁铵{(NH4)3[Fe(C2O4)3]}常用于摄影和蓝色印刷等,其制备原理为:Fe(OH)3+3NH4HC2O4=(NH4)3[Fe(C2O4)3]+3H2O。
回答下列问题:
(1)基态C原子核外电子云有__ 种形状;基态铁原子最先失去__ 能级(填能级符号)上的电子。
(2)(NH4)3[Fe(C2O4)3]中C2O 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
①该配合物中所含非金属元素的电负性由大到小的顺序为__ (用元素符号表示)。
②上述配合物的中心离子配位数为___ 。
③1molC2O 中含有σ键的数目为
中含有σ键的数目为__ 在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键简称大π键。如苯的大π键可表示为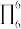 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为__ 。
(3)写出一种与NH 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式__ ;N元素的一种同素异形体N4中所有原子均满足8电子稳定结构,N4的结构式为__ ;CH4、NH3、H2O分子中键角由大到小的顺序为__ 。
(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为__ g·cm-3。

回答下列问题:
(1)基态C原子核外电子云有
(2)(NH4)3[Fe(C2O4)3]中C2O
 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。①该配合物中所含非金属元素的电负性由大到小的顺序为
②上述配合物的中心离子配位数为
③1molC2O
 中含有σ键的数目为
中含有σ键的数目为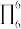 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为(3)写出一种与NH
 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为

您最近一年使用:0次
2021-01-31更新
|
549次组卷
|
2卷引用:贵州省盘州市2021届高三第一次模拟考试理科综合化学试题
解题方法
4 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)Co3+的价电子排布图为:___ ;基态磷原子有___ 种空间运动状态不同的电子。
(2)Li、O、P三种元素的电负性由大到小的顺序是:___ 。
(3)写出一种与PO 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:___ ,该分子的中心原子的价层电子对数等于___ 。
(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:___ 。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:___ 。
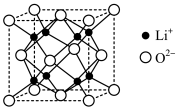
(6)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:___ ,若晶胞参数为bnm,阿伏加德罗常数的值为NA,则Li2O的密度为___ g·cm-3(列出计算式即可),O2-和Li+的最短距离等于__ nm(用含b的代数式表示)。
(1)Co3+的价电子排布图为:
(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)写出一种与PO
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:
(6)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:

您最近一年使用:0次
名校
解题方法
5 . 钛单质及其化合物在医疗器械和军工业生产中有重要应用。
(1)基态钛原子核外电子排布式为___________ ;同周期与其未成对电子数相等的基态原子还有___________ 种。
(2)氢氟酸是钛的最强溶剂,可发生反应:Ti+4HF=TiF4+2H2↑。
①上述反应涉及的三种元素电负性由强到弱的顺序为___________ 。
②HF和HCl相比较,沸点较高的是___________ ,原因为___________ 。
(3)钛酸钡(BaTiO3)被誉为“电子陶瓷工业的支柱”,其制备原理为BaTiO(C2O4)2·4H2O BaTiO3+2CO↑+2CO2↑+4H2O。
BaTiO3+2CO↑+2CO2↑+4H2O。
①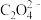 中碳原子的杂化方式为
中碳原子的杂化方式为___________ ;CO2分子的空间构型为___________ 。
②钛酸钡(BaTiO3)的晶胞为立方晶胞,结构如下图。其中部分原子坐标为W(0,0, 0)、M(1/2,1/2,1/2)、N(1/2,0,0)。

晶胞中Ba与Ti的配位数分别为___________ 、___________ ;X点的坐标为___________ ;若晶胞参数为a pm,则该晶胞的密度为___________ (NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
(1)基态钛原子核外电子排布式为
(2)氢氟酸是钛的最强溶剂,可发生反应:Ti+4HF=TiF4+2H2↑。
①上述反应涉及的三种元素电负性由强到弱的顺序为
②HF和HCl相比较,沸点较高的是
(3)钛酸钡(BaTiO3)被誉为“电子陶瓷工业的支柱”,其制备原理为BaTiO(C2O4)2·4H2O
 BaTiO3+2CO↑+2CO2↑+4H2O。
BaTiO3+2CO↑+2CO2↑+4H2O。①
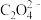 中碳原子的杂化方式为
中碳原子的杂化方式为②钛酸钡(BaTiO3)的晶胞为立方晶胞,结构如下图。其中部分原子坐标为W(0,0, 0)、M(1/2,1/2,1/2)、N(1/2,0,0)。

晶胞中Ba与Ti的配位数分别为
您最近一年使用:0次
名校
解题方法
6 . 原子序数小于等于36的Q、W、X、Y、Z五种元素,其中Q是形成化合物种类最多的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是______ 。
(2)1molQWX与1molWQ2Y所含σ键的比值为______ 。
(3)根据等电子体理论可以预测WXY-的空间构型为______ 。
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为______ 。
(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。______ 。
②该化合物所属晶体类型为______ 晶体,预测其熔点应______ 金刚石(填“高于”或“低于”)。
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是
(2)1molQWX与1molWQ2Y所含σ键的比值为
(3)根据等电子体理论可以预测WXY-的空间构型为
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。
②该化合物所属晶体类型为
您最近一年使用:0次
2021-03-14更新
|
326次组卷
|
3卷引用:江苏省如皋中学2020届高三阶段检测化学试题
名校
解题方法
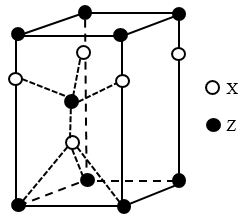
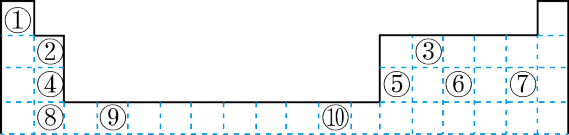
7 . 下表为长式周期表的一部分其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为___________ ,其中元素③的基态原子的电子排布图为_______ ;①和⑥形成的一种常见四原子分子的化学式为_______ ,该分子的立体构型为______ 。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程___________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
您最近一年使用:0次
名校
解题方法
8 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示:
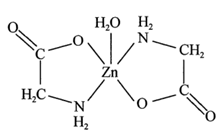
(1)基态 核外价电子排布图为
核外价电子排布图为___________ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的排列顺序为___________ 。
(2)甘氨酸(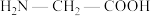 )的羧基中C原子的杂化轨道类型为
)的羧基中C原子的杂化轨道类型为___________ ;甘氨酸易溶于水,试从结构角度解释:___________ 。
(3)以氧化锌矿物为原料,提取锌的过程中涉及反应: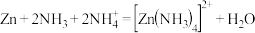 。与
。与 互为等电子体的阴离子为
互为等电子体的阴离子为___________ (写出1种即可);
(4).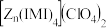 是
是 的另一种配合物,
的另一种配合物, 的结构为
的结构为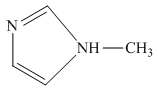 ,则
,则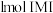 中含有
中含有___________ 个 键;常温下
键;常温下 的某种衍生物与甘氨酸形成的离子化合物
的某种衍生物与甘氨酸形成的离子化合物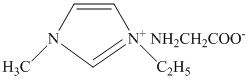 为液态而非固态,其原因是
为液态而非固态,其原因是___________ 。
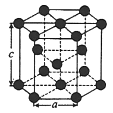
(5)金属 晶体中的原子堆积方式如图所示,这种堆积方式称为
晶体中的原子堆积方式如图所示,这种堆积方式称为___________ ;六棱柱底边边长为 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为___________  (列出算式即可)。
(列出算式即可)。

(1)基态
 核外价电子排布图为
核外价电子排布图为(2)甘氨酸(
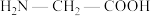 )的羧基中C原子的杂化轨道类型为
)的羧基中C原子的杂化轨道类型为(3)以氧化锌矿物为原料,提取锌的过程中涉及反应:
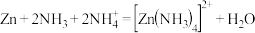 。与
。与 互为等电子体的阴离子为
互为等电子体的阴离子为(4).
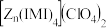 是
是 的另一种配合物,
的另一种配合物, 的结构为
的结构为 ,则
,则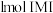 中含有
中含有 键;常温下
键;常温下 的某种衍生物与甘氨酸形成的离子化合物
的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态,其原因是
为液态而非固态,其原因是(5)金属
 晶体中的原子堆积方式如图所示,这种堆积方式称为
晶体中的原子堆积方式如图所示,这种堆积方式称为 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为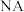 ,则
,则 的密度为
的密度为 (列出算式即可)。
(列出算式即可)。
您最近一年使用:0次
名校
解题方法
9 . C、Si在元素周期表中属于同主族元素,其常见的氧化物分别为CO2、SiO2。请回答下列问题:
(1)锗与碳、硅同主族,写出锗原子基态时的核外电子排布式:____________ 。
(2)C、O、Si三种元素的电负性由大到小的顺序为____________ (用元素符号表示)。
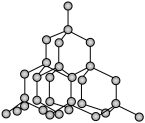
(3)二氧化硅结构跟硅晶体结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察下图中硅晶体的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目为____________ ;晶体硅中硅原子与共价键的数目比为____________ 。
(4)下图是二氧化碳的晶胞模型,从晶体类型来看,CO2属于_______ 晶体。图中显示出的二氧化碳分子数有________ 个,实际上一个二氧化碳晶胞中含有_______ 个二氧化碳分子。标准状况下2.24 L的CO2分子中含有的π键的数目为______ 。
(5)在二氧化碳晶胞中,最近的两个二氧化碳分子间的距离为a nm,NA为阿伏加 德罗常数的值,则晶体密度为____________ g·cm-3。
(1)锗与碳、硅同主族,写出锗原子基态时的核外电子排布式:
(2)C、O、Si三种元素的电负性由大到小的顺序为
(3)二氧化硅结构跟硅晶体结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察下图中硅晶体的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目为
(4)下图是二氧化碳的晶胞模型,从晶体类型来看,CO2属于
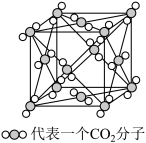
(5)在二氧化碳晶胞中,最近的两个二氧化碳分子间的距离为a nm,NA为阿伏加 德罗常数的值,则晶体密度为
您最近一年使用:0次
2020-09-22更新
|
347次组卷
|
3卷引用:辽宁省朝阳市建平县2021届高三9月联考化学试题
名校
解题方法
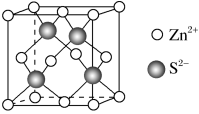
10 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图。 的价电子排布式为
的价电子排布式为_______ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是_______ 。
(2)甘氨酸(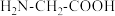 )中N的杂化轨道类型为
)中N的杂化轨道类型为_______ ;甘氨酸易溶于水,试从结构角度解释_______ 。
(3)一水合甘氨酸锌中 的配位数为
的配位数为_______ 。 填入
填入 组成
组成_______ 空隙中;
②由①能否判断出 、
、 相切?
相切?_______ (填“能”或“否”);
③已知晶体密度为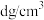 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为_______ pm(写计算表达式)。
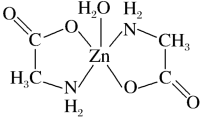
 的价电子排布式为
的价电子排布式为(2)甘氨酸(
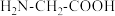 )中N的杂化轨道类型为
)中N的杂化轨道类型为(3)一水合甘氨酸锌中
 的配位数为
的配位数为(4) 是
是 的另一种配合物,IMI的结构为
的另一种配合物,IMI的结构为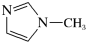 ,常温下IMI的某种衍生物与甘氨酸形成的离子化合物
,常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态。原因是
为液态而非固态。原因是
 填入
填入 组成
组成②由①能否判断出
 、
、 相切?
相切?③已知晶体密度为
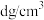 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为
您最近一年使用:0次
2021-01-03更新
|
379次组卷
|
6卷引用:四川省成都市2020届高三第一次诊断性检测理综化学试题



