名校
解题方法
1 . 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O
(1)X基态原子的电子排布式为______ .
(2)C、H、O三种原子的电负性由大到小的顺序为______ .
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:
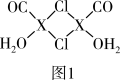
①与CO为互为等电子体的分子是______ .
②该配合物中氯原子的杂化方式为______ .
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______ .
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______ .XCl的化学式__________

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=_____________ (无需化简,列式即可)。
(1)X基态原子的电子排布式为
(2)C、H、O三种原子的电负性由大到小的顺序为
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:

①与CO为互为等电子体的分子是
②该配合物中氯原子的杂化方式为
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=
您最近一年使用:0次
名校
解题方法
2 . 碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________ ;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________ (填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________ 个B相连,As的杂化形式为_______________ ;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________ (填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________ (填晶体类型)。
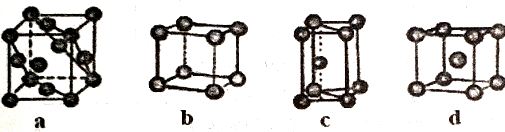
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________ (填字母)。
(6)石墨晶体的结构如下图,石墨的密度为________________________________ (只列式不化简不计算)
(1)基态As原子的电子排布式为[Ar]
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为

(6)石墨晶体的结构如下图,石墨的密度为

您最近一年使用:0次
解题方法
3 . 天宫二号空间实验室于2016年9月15 日在酒泉卫星发射中心发射成功。实验室承载了10余项太空实验,其中包含了好比科幻英雄“综合材料”多晶碲化锌(ZnTe)的实验。
(1)电负性Zn___________ Te(填“>”或“<”或“=”)。
(2)O、S、Se与Te元素位于同一主族。基态碲(Te)原子核外电子排布式为[Kr]________ ,有_______ 个未成对电子。
(3)H2O、H2S、H2Se沸点由低到高顺序为______ ,推断的依据是_______ ;SO2分子中S原子采取_____ 杂化;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是____________ 。
(4)向氯化锌溶液中加入过量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化学键有共价键、____ 、_______ 。
(5)碲化锌晶体有两种结构,其中一种晶胞结构如下图:
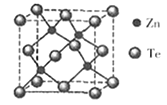
晶胞中含有_____ 个Te原子;与Te原子距离最近的Te原子有______ 个;若两个距离最近的Te原子间距为apm.则晶体密度为_________ g/cm3。
(1)电负性Zn
(2)O、S、Se与Te元素位于同一主族。基态碲(Te)原子核外电子排布式为[Kr]
(3)H2O、H2S、H2Se沸点由低到高顺序为
(4)向氯化锌溶液中加入过量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化学键有共价键、
(5)碲化锌晶体有两种结构,其中一种晶胞结构如下图:

晶胞中含有
您最近一年使用:0次
名校
解题方法
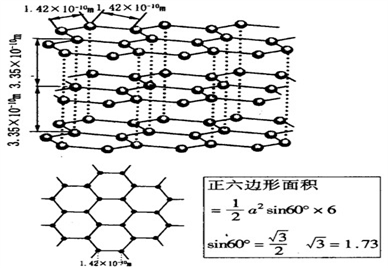
4 . 图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________ 。
(2)ABC的第一电离能由大到小的顺序______________ (用元素符号表示)。
(3)B元素单质分子中的_______ 个π键,与其互为等电子体的阴离子为____________________ 。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________ 杂化,每个分子周围有_____ 个分子与之距离相等且最近。若晶胞棱长为a pm,则该晶体密度的表达式为________ g·cm-3。
(5)G元素的氢化物分子的空间构型为________ ,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同__________ ?(填“相同”或“不同”)。

试回答下列问题:
(1)F元素基态原子的核外电子排布式为
(2)ABC的第一电离能由大到小的顺序
(3)B元素单质分子中的
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用
(5)G元素的氢化物分子的空间构型为
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同
您最近一年使用:0次
名校
解题方法
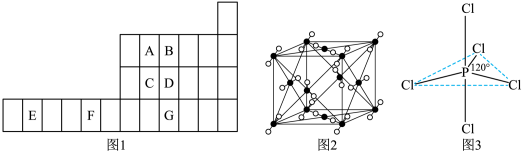
5 . 2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主。已知砷化镓的晶胞结构如图。试回答:

(1)镓的基态原子的外围电子排布式是_______________ 。
(2)镓与钾、钙元素的第一电离能从大到小依次为_________________________ ,与其在同一周期的砷、硒和溴的电负性从大到小依次为_______________ 。(填元素符号)
(3)此晶胞中所含的砷原子(白色球)个数为_______ ,与同一个镓原子相连的砷原子构成的立体构型为___________ ,镓采取的杂化方式为________________ 。
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为_____________________ ,其结构式为_____________ ,硼酸是_______ 元酸。
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为________ cm,NA表示阿伏伽德罗常数,则该晶体的密度为________ g/cm3。

(1)镓的基态原子的外围电子排布式是
(2)镓与钾、钙元素的第一电离能从大到小依次为
(3)此晶胞中所含的砷原子(白色球)个数为
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为
您最近一年使用:0次
解题方法
6 . Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子。
(1)Z原子的价电子排布式为_________________ 。
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是_______________ 。
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为___________ ,从原子结构的角度解释不存在RCl5分子的原因_______ 。
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为_______________ 。
②甲→乙的化学方程式为______________ 。
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为______________ 。
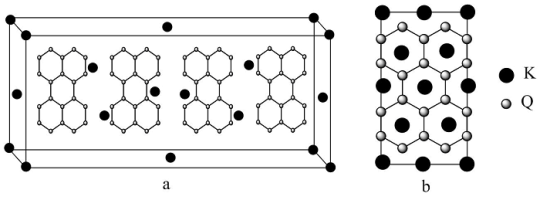
(1)Z原子的价电子排布式为
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为
②甲→乙的化学方程式为
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为

您最近一年使用:0次
名校
解题方法
7 . 如表所示为三种同一短周期元素的各级电离能数据(单位:kJ·mol-1)。下列说法正确的是
| 电离能 元素代号 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 740 | 1500 | 7700 | 10500 |
| Z | 580 | 1800 | 2700 | 11600 |
| A.电负性:Y>Z |
| B.同周期元素第一电离能大于Y的有5种元素 |
| C.X位于s区,Y、Z位于p区 |
| D.X元素可能是Li |
您最近一年使用:0次
名校
解题方法
8 . H、C、N、O、Na、Mg、Cl、Cu是8种中学化学中常见的元素。
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是___________ 。
② 3种元素Na、Mg、Cl中,原子半径最大的是___________ 。
③ 基态Cu的价电子排布式为___________ 。
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是___________ (填字母)。
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH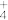 的原因是
的原因是___________ 。
③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是___________ 。
(3)不同聚集状态的物质与性质___________ 。
②金属钠能导电的原因是___________ 。
③NaCl、NaBr、NaI中,熔点最高的是___________ 。
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是___________ (填字母)。
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是
② 3种元素Na、Mg、Cl中,原子半径最大的是
③ 基态Cu的价电子排布式为
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH
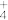 的原因是
的原因是③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是
(3)不同聚集状态的物质与性质
②金属钠能导电的原因是
③NaCl、NaBr、NaI中,熔点最高的是
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
您最近一年使用:0次
9 . 下列比较中不正确的是
| A.键角:CH4>NH3>H2O |
| B.键的极性:N-H键<O-H键<F-H键 |
| C.酸性:CH2ClCOOH>CCl3COOH |
D.沸点: |
您最近一年使用:0次
名校
解题方法
10 . 含硒(Se)化合物在材料药物领域有重要应用。
(1)Se与S同族,基态Se原子的简化电子排布式为___________ ,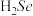 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(2)一种含硒的新型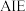 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(3)硒的两种含氧酸的酸性强弱为
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠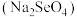 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒,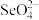 的空间结构为
的空间结构为___________ 。
(4)铊( )与
)与 同族,第一电离能
同族,第一电离能
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)根据下表中元素的电负性数值判断, 为
为___________ (填“离子化合物”或“共价化合物”,下同), 为
为___________ 。
(6)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为___________ 。 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Se与S同族,基态Se原子的简化电子排布式为
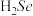 的沸点高于
的沸点高于 ,原因是
,原因是(2)一种含硒的新型
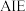 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。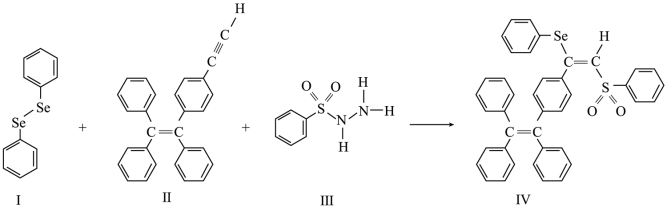
A.Ⅰ中含有两种元素, 键为非极性键 键为非极性键 |
B.Ⅱ中C原子的杂化轨道类型有 与 与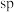 |
| C.Ⅲ中含有的元素中,O的电负性最大 |
D.Ⅳ中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
(3)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠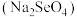 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒,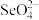 的空间结构为
的空间结构为(4)铊(
 )与
)与 同族,第一电离能
同族,第一电离能
 (填“>”或“<”)。
(填“>”或“<”)。(5)根据下表中元素的电负性数值判断,
 为
为 为
为| 元素 | F |  |  |
| 电负性 | 4.0 | 1.5 | 3.0 |
(6)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
|
|
| 图a | 图b |
您最近一年使用:0次