解题方法
1 . 大麻二酚(CBD)具有降血糖、抗肿瘤、抗焦虑等多种生物活性。以下是CBD在医药工业上的一种合成路线,回答下列问题。___________ 。
(2)B的结构为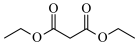 ,其化学名称是
,其化学名称是___________ ;D中含氧官能团的名称是___________ 。
(3)写出由E生成G的化学方程式___________ ,该反应类型为___________ 。
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有___________ 种。(不考虑立体异构)
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是___________ (写出结构简式)。
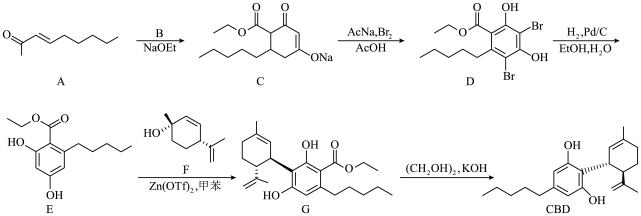
(5)已知:R-CN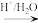 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成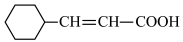 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):___________ 。
(2)B的结构为
 ,其化学名称是
,其化学名称是(3)写出由E生成G的化学方程式
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是
(5)已知:R-CN
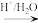 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):
您最近一年使用:0次
解题方法
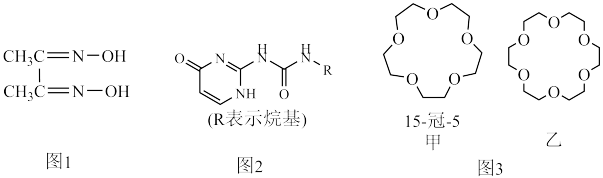
2 . 配合物和超分子广泛应用于新材料合成、物质的鉴别和分离。如丁二酮肟(如图1)可用于鉴别 Ni2+,嘧啶衍生物(如图2)是形成高韧性超分子的单体,冠醚(如图3)是皇冠状分子,可有大小不同的空穴适配不同大小的碱金属离子。
(1)基态 Ni2+核外未成对电子的数目为______ 。
(2)丁二酮肟与 Ni²⁺生成血红色配合物的结构为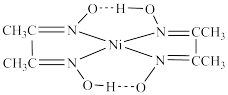 ,相同压强下,该配合物的沸点低于干二酮肟的原因为
,相同压强下,该配合物的沸点低于干二酮肟的原因为_______ 。
(3)Ni在一定条件下可与CO形成 Ni(CO)x,分子中每个Ni原子的价电子数及其周围CO提供的成键电子数之和为18,则x=_______ 。
(4)图2所示分子所含元素电负性由小到大的顺序为______ 。
(5)冠醚是状如皇冠的一类醚,分子中存在空穴,图3中甲、乙两种冠醚可分别识别 Na+、K+,其主要原因为________ ;乙的名称为______ 。
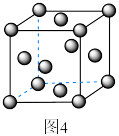
(6)金属Ni的立方晶胞结构如图4所示,则Ni的空间利用率为________ (用含π的代式表示)。
(1)基态 Ni2+核外未成对电子的数目为
(2)丁二酮肟与 Ni²⁺生成血红色配合物的结构为
 ,相同压强下,该配合物的沸点低于干二酮肟的原因为
,相同压强下,该配合物的沸点低于干二酮肟的原因为(3)Ni在一定条件下可与CO形成 Ni(CO)x,分子中每个Ni原子的价电子数及其周围CO提供的成键电子数之和为18,则x=
(4)图2所示分子所含元素电负性由小到大的顺序为
(5)冠醚是状如皇冠的一类醚,分子中存在空穴,图3中甲、乙两种冠醚可分别识别 Na+、K+,其主要原因为
(6)金属Ni的立方晶胞结构如图4所示,则Ni的空间利用率为
您最近一年使用:0次
解题方法
3 . 非金属元素及其化合物在生产、生活中占据重要地位。回答下列问题:
(1)基态Se原子核外电子占据的最高能级符号为____ ,该能级的电子云轮廓图形为_____ 形。
(2)H2O、H2S、H2Se的沸点由高到低的顺序为_____ (填化学式,下同),酸性由强到弱的顺序为______ 。
(3)下列分子或离子与CO2具有相同类型的化学键和立体结构的是_______ (填标号)。
a.SO2 b.CS2 c.OF2 d.NO
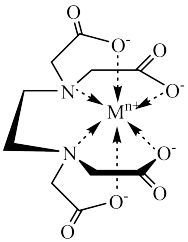
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA螯合物的结构如下图所示,EDTA的配体数为_____ ,EDTA中C原子的杂化方式为_____ ,1molEDTA通过螯合作用形成了_____ mol五元环。
(1)基态Se原子核外电子占据的最高能级符号为
(2)H2O、H2S、H2Se的沸点由高到低的顺序为
(3)下列分子或离子与CO2具有相同类型的化学键和立体结构的是
a.SO2 b.CS2 c.OF2 d.NO

(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA螯合物的结构如下图所示,EDTA的配体数为

您最近一年使用:0次
名校
解题方法
4 . 【物质结构与性质】
硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与 的结构密切相关,
的结构密切相关, 的立体构型为
的立体构型为____ 。P、O、S的电负性从大到小的顺序为______________ ____ (填标号)。
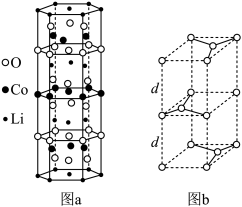
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____ ,Co3+的价层电子排布式为_____ 。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加 德罗常数为____ mol-l。
硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与
 的结构密切相关,
的结构密切相关, 的立体构型为
的立体构型为(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(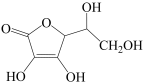 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是
A. B.
B.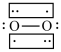 C.
C.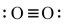 D.
D.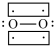
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加 德罗常数为
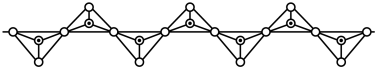
(5)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“ ”表示Si原子,“
”表示Si原子,“ ”表示氧原子,则该长链硅酸根离子的通式为
”表示氧原子,则该长链硅酸根离子的通式为
您最近一年使用:0次
解题方法
5 . 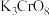 、
、 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
(1)基态Cr原子的未成对电子数为________________ 。
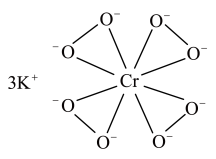
(2)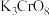 的结构如图所示。
的结构如图所示。
①下列有关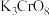 的说法正确的是
的说法正确的是__________ (填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,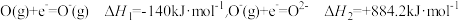 。氧的第一电子亲和能E1为
。氧的第一电子亲和能E1为__________ kJ/mol;△H2>0,其原因是_____________________________________ 。
(3)雷氏盐的化学式为 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________ 。
②其阳离子的中心原子的杂化方式为_________________ ,配体之一NH3分子的立体构型为______ 。
③与配体NCSˉ互为等电子体的阴离子有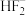 等,分子有
等,分子有_____________________ (写1种);画出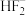 的结构式:
的结构式:_____________________________ 。
(4)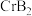 的晶体密度为
的晶体密度为 ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加 德罗常数的值为NA,则a2c=
,设阿伏加 德罗常数的值为NA,则a2c=_______________ (列出计算式)。
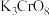 、
、 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
(1)基态Cr原子的未成对电子数为
(2)
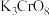 的结构如图所示。
的结构如图所示。①下列有关
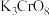 的说法正确的是
的说法正确的是A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
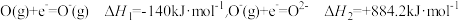 。氧的第一电子亲和能E1为
。氧的第一电子亲和能E1为(3)雷氏盐的化学式为
 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②其阳离子的中心原子的杂化方式为
③与配体NCSˉ互为等电子体的阴离子有
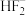 等,分子有
等,分子有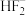 的结构式:
的结构式:(4)
 的晶体密度为
的晶体密度为 ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加 德罗常数的值为NA,则a2c=
,设阿伏加 德罗常数的值为NA,则a2c=
您最近一年使用:0次
名校
解题方法
6 . 我国是世界上最早制得和使用金属锌的国家,锌在人类生产生活中有重要应用。回答下列问题:
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:
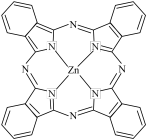
(1)Zn2+价电子轨道表示式为__________ 。
(2)该配合物中电负性最大的元素是__________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
(4)该配合物中 C 的轨道杂化类型为__________ 。
(5)该配合物中 Zn2+的配位数为__________ 个。
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。
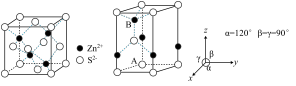
下列说法错误的是__________。(填序号)
(7)立方 ZnS 中,若 Zn2+与 S2-最短距离为 a nm,则晶胞密度ρ=__________ g·cm-3(列出计算式,阿伏加德罗常数的值为 NA)。
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:

(1)Zn2+价电子轨道表示式为
(2)该配合物中电负性最大的元素是
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
| A.[He]2s22p3 | B.[He]2s22p2 |
| C.[He]2s22p23s1 | D.[He]2s22p13s1 |
(5)该配合物中 Zn2+的配位数为
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。

下列说法错误的是__________。(填序号)
| A.立方 ZnS 中与 S2—最近的 S2—有 12 个 | B.两种晶胞中 Zn2+的个数都为4 |
| C.立方 ZnS 中 S2—的配位数为 4 | D.可用 X—射线衍射实验鉴别六方 ZnS 是否属于晶体 |
您最近一年使用:0次
名校
解题方法
7 . 钛单质及其化合物在医疗器械和军工业生产中有重要应用。
(1)基态钛原子核外电子排布式为___________ ;同周期与其未成对电子数相等的基态原子还有___________ 种。
(2)氢氟酸是钛的最强溶剂,可发生反应:Ti+4HF=TiF4+2H2↑。
①上述反应涉及的三种元素电负性由强到弱的顺序为___________ 。
②HF和HCl相比较,沸点较高的是___________ ,原因为___________ 。
(3)钛酸钡(BaTiO3)被誉为“电子陶瓷工业的支柱”,其制备原理为BaTiO(C2O4)2·4H2O BaTiO3+2CO↑+2CO2↑+4H2O。
BaTiO3+2CO↑+2CO2↑+4H2O。
①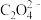 中碳原子的杂化方式为
中碳原子的杂化方式为___________ ;CO2分子的空间构型为___________ 。
②钛酸钡(BaTiO3)的晶胞为立方晶胞,结构如下图。其中部分原子坐标为W(0,0, 0)、M(1/2,1/2,1/2)、N(1/2,0,0)。

晶胞中Ba与Ti的配位数分别为___________ 、___________ ;X点的坐标为___________ ;若晶胞参数为a pm,则该晶胞的密度为___________ (NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
(1)基态钛原子核外电子排布式为
(2)氢氟酸是钛的最强溶剂,可发生反应:Ti+4HF=TiF4+2H2↑。
①上述反应涉及的三种元素电负性由强到弱的顺序为
②HF和HCl相比较,沸点较高的是
(3)钛酸钡(BaTiO3)被誉为“电子陶瓷工业的支柱”,其制备原理为BaTiO(C2O4)2·4H2O
 BaTiO3+2CO↑+2CO2↑+4H2O。
BaTiO3+2CO↑+2CO2↑+4H2O。①
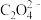 中碳原子的杂化方式为
中碳原子的杂化方式为②钛酸钡(BaTiO3)的晶胞为立方晶胞,结构如下图。其中部分原子坐标为W(0,0, 0)、M(1/2,1/2,1/2)、N(1/2,0,0)。

晶胞中Ba与Ti的配位数分别为
您最近一年使用:0次
8 . 孔雀石(主要成分为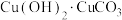 )和蓝铜矿(主要成分为
)和蓝铜矿(主要成分为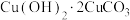 )是两种常见颜料。下列说法
)是两种常见颜料。下列说法不正确 的是
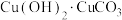 )和蓝铜矿(主要成分为
)和蓝铜矿(主要成分为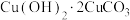 )是两种常见颜料。下列说法
)是两种常见颜料。下列说法A.原子半径: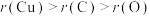 | B.电负性: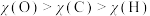 |
| C.孔雀石、蓝铜矿颜料不易被空气氧化 | D.基态Cu+离子3d轨道上有9个电子 |
您最近一年使用:0次
解题方法
9 . 碳、氧、氮、镁、铬、铁、锌是几种重要的元素,请回答下列问题:
(1)铝的基态原子的价电子排布式是_________________ 。
(2)用水解法制备一种磁性材料铁氧体时常加入尿素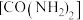 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________ ,分子中 键和
键和 键的数目之比为
键的数目之比为__________ 。醋酸钠中碳原子的杂化类型为____________ 。
(3)Mg2+、 等金属离子与
等金属离子与 、
、 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________  填“
填“ ”或“
”或“ ”
” ,其原因是
,其原因是__________ ;已知氨 熔点:
熔点: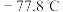 、沸点:
、沸点: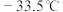 ,联氨
,联氨 熔点:
熔点: 、沸点:
、沸点: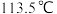 ,解释其熔沸点高低的主要原因:
,解释其熔沸点高低的主要原因:______________ 。
(4)碳溶解在 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________ 。若晶体密度为 ,则晶胞中最近的两个碳原子的距离为
,则晶胞中最近的两个碳原子的距离为__________ 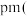 阿伏加 德罗常数的值用
阿伏加 德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 。
。

(1)铝的基态原子的价电子排布式是
(2)用水解法制备一种磁性材料铁氧体时常加入尿素
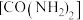 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是 键和
键和 键的数目之比为
键的数目之比为(3)Mg2+、
 等金属离子与
等金属离子与 、
、 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是 填“
填“ ”或“
”或“ ”
” ,其原因是
,其原因是 熔点:
熔点: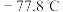 、沸点:
、沸点: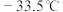 ,联氨
,联氨 熔点:
熔点: 、沸点:
、沸点: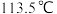 ,解释其熔沸点高低的主要原因:
,解释其熔沸点高低的主要原因:(4)碳溶解在
 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为 ,则晶胞中最近的两个碳原子的距离为
,则晶胞中最近的两个碳原子的距离为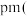 阿伏加 德罗常数的值用
阿伏加 德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 。
。 
您最近一年使用:0次
2020-01-27更新
|
189次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——物质结构与性质
名校
解题方法
10 . 自然界中,纯粹的典型晶体是不多的,大多数晶体是分子晶体、共价晶体、金属晶体和离子晶体之间的过渡晶体。以下列出了第三周期几种氧化物晶体中离子键的百分数。
提示:离子键的百分数是通过电负性的差值计算出来的,电负性的差值越大,离子键的百分数越大。
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:___________ 。
(2)硅元素位于元素周期表的___________ 区。基态硅原子的价层电子排布式为___________ 。
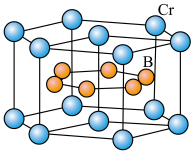
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为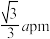 。
。
①该物质化学式为___________ ;
②距离每个B原子最近的Mg原子有___________ 个;
③该晶体密度为___________  。
。 含量。
含量。
(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色) (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为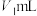 ,体系中有沉淀。
,体系中有沉淀。
(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入 。
。
(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液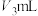 。
。
已知: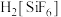 为强电解质,回答问题:
为强电解质,回答问题:
①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式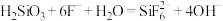 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为___________ 。
②样品中硅酸钠的纯度为___________ (用质量分数表示)。
| 氧化物 |  | MgO |  |  |
| 离子键百分数 | 62 | 50 | 41 | 33 |
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:
(2)硅元素位于元素周期表的
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为
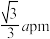 。
。①该物质化学式为
②距离每个B原子最近的Mg原子有
③该晶体密度为
 。
。
 含量。
含量。(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色)
 (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为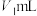 ,体系中有沉淀。
,体系中有沉淀。(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入
 。
。(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液
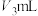 。
。已知:
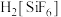 为强电解质,回答问题:
为强电解质,回答问题:①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式
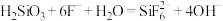 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为②样品中硅酸钠的纯度为
您最近一年使用:0次



