名校
解题方法
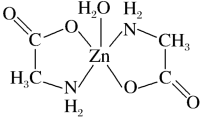
1 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图。 的价电子排布式为
的价电子排布式为_______ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是_______ 。
(2)甘氨酸(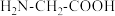 )中N的杂化轨道类型为
)中N的杂化轨道类型为_______ ;甘氨酸易溶于水,试从结构角度解释_______ 。
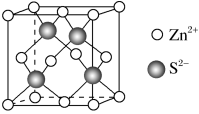
(3)一水合甘氨酸锌中 的配位数为
的配位数为_______ 。 填入
填入 组成
组成_______ 空隙中;
②由①能否判断出 、
、 相切?
相切?_______ (填“能”或“否”);
③已知晶体密度为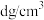 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为_______ pm(写计算表达式)。
 的价电子排布式为
的价电子排布式为(2)甘氨酸(
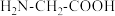 )中N的杂化轨道类型为
)中N的杂化轨道类型为(3)一水合甘氨酸锌中
 的配位数为
的配位数为(4) 是
是 的另一种配合物,IMI的结构为
的另一种配合物,IMI的结构为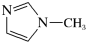 ,常温下IMI的某种衍生物与甘氨酸形成的离子化合物
,常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态。原因是
为液态而非固态。原因是
 填入
填入 组成
组成②由①能否判断出
 、
、 相切?
相切?③已知晶体密度为
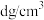 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为
您最近一年使用:0次
2021-01-03更新
|
379次组卷
|
6卷引用:四川省成都市2020届高三第一次诊断性检测理综化学试题
解题方法
2 . 我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如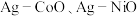 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如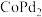 等)。
等)。
回答下列问题:
(1)十八胺中含有氮元素,含氮元素的三种离子 的键角由大到小的顺序是
的键角由大到小的顺序是___________ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物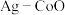 而非
而非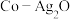 的原因是
的原因是___________ 。
(4)推测 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为___________ 。
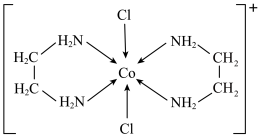
(5)一种含钴的离子结构如图所示: 的价电子轨道表示式是
的价电子轨道表示式是___________ 。已知磁矩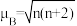 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩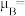
___________ 。
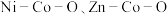 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如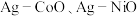 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如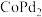 等)。
等)。
| 元素 |  |  |  |  |  |  |  |
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺中含有氮元素,含氮元素的三种离子
 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)以
 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物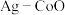 而非
而非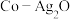 的原因是
的原因是(4)推测
 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为(5)一种含钴的离子结构如图所示:
 的价电子轨道表示式是
的价电子轨道表示式是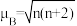 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩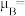
您最近一年使用:0次
解题方法
3 . 近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料( Bi - MOF),反应可简单表示为Bi( NO3)3·5H2O + BTC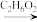 Bi – MOF。回答下列问题:
Bi – MOF。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为___________ 。
Bi(NO3)3中阴离子的立体构型为___________ 。基态O原子核外成对电子数与未成对电子数之比为___________ 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为___________ 。C2H5OH的沸点高于CH3OCH3,原因是___________ 。
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。
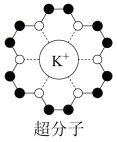
已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为___________ 。
②下列叙述正确的是___________ (填字母)。
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。
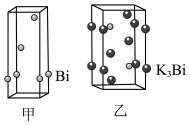
①等晶胞数的甲、乙中含铋原子数之比为___________ 。
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度___________ g·cm-3(只列计算式)。
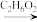 Bi – MOF。回答下列问题:
Bi – MOF。回答下列问题:(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为
Bi(NO3)3中阴离子的立体构型为
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。

已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为
②下列叙述正确的是
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。

①等晶胞数的甲、乙中含铋原子数之比为
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度
您最近一年使用:0次
解题方法
4 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代 丁基
丁基 甲基咪唑离子液
甲基咪唑离子液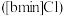 可以与
可以与 混合形成离子液体;
混合形成离子液体;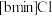 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是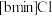 与
与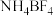 离子交换反应合成离子液体
离子交换反应合成离子液体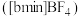 的流程:
的流程:

(1)请画出基态 原子的价电子排布图
原子的价电子排布图___________ ;同周期元素中基态原子未成对电子数与硼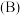 原子相同的有
原子相同的有___________ (填元素符号)。
(2)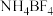 中N原子的杂化方式为
中N原子的杂化方式为___________ ,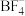 的空间构型为
的空间构型为___________ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为___________ 。
(3)已知分子中的大 键可以用
键可以用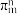 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为___________ 。
(4) 熔点为
熔点为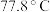 ,则
,则 的晶体类型为
的晶体类型为___________ , 和
和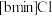 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: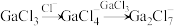 ,请画出
,请画出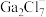 的结构式
的结构式___________ 。
(5)某种 的晶胞结构如图所示,
的晶胞结构如图所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在
在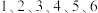 构成的八面体体心)。
构成的八面体体心)。
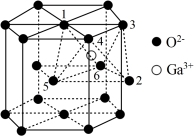
①该晶胞中 的配位数为
的配位数为___________ 。
②该晶胞有___________  (保留一位小数)八面体空隙未填充阳离子。
(保留一位小数)八面体空隙未填充阳离子。
③已知氧离子半径为 ,晶胞的高为
,晶胞的高为 代表阿伏加德罗常数的值,该晶体的密度为
代表阿伏加德罗常数的值,该晶体的密度为___________  (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
 丁基
丁基 甲基咪唑离子液
甲基咪唑离子液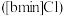 可以与
可以与 混合形成离子液体;
混合形成离子液体;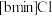 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是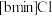 与
与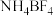 离子交换反应合成离子液体
离子交换反应合成离子液体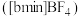 的流程:
的流程:
(1)请画出基态
 原子的价电子排布图
原子的价电子排布图 原子相同的有
原子相同的有(2)
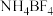 中N原子的杂化方式为
中N原子的杂化方式为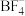 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用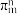 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为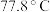 ,则
,则 的晶体类型为
的晶体类型为 和
和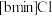 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: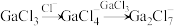 ,请画出
,请画出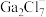 的结构式
的结构式(5)某种
 的晶胞结构如图所示,
的晶胞结构如图所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在
在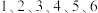 构成的八面体体心)。
构成的八面体体心)。
①该晶胞中
 的配位数为
的配位数为②该晶胞有
 (保留一位小数)八面体空隙未填充阳离子。
(保留一位小数)八面体空隙未填充阳离子。③已知氧离子半径为
 ,晶胞的高为
,晶胞的高为 代表阿伏加德罗常数的值,该晶体的密度为
代表阿伏加德罗常数的值,该晶体的密度为 (用含
(用含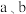 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2021-04-19更新
|
298次组卷
|
2卷引用:重庆市普通高中学业水平选择性考试2021届高三第二次联合诊断检测化学试题
5 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、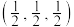 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、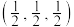 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
解题方法
6 . 完成下列问题。
(1)基态铬的核外电子排布式是:_______ ,其在周期表中的位置是_______ 。
(2) 可以形成的一种配合物是
可以形成的一种配合物是 ,
,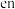 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为_______ ,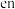 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为_______ 。
(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=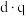 。
。
①请写出一种μ=0的分子_______ 。
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为_______ 。
③治癌药物 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为_______ 。
(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。
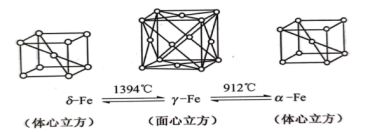
①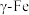 晶体中
晶体中 原子的配位数是
原子的配位数是_______ 。
②若 晶胞边长为a,
晶胞边长为a,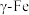 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为_______ 。
(1)基态铬的核外电子排布式是:
(2)
 可以形成的一种配合物是
可以形成的一种配合物是 ,
,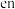 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为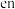 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=
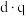 。
。①请写出一种μ=0的分子
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为
③治癌药物
 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。

①
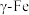 晶体中
晶体中 原子的配位数是
原子的配位数是②若
 晶胞边长为a,
晶胞边长为a,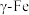 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为
您最近一年使用:0次
解题方法
7 . 近来,嫦娥五号完成“挖土”之旅返回地球。查阅资料知,月球玄武岩是构成月球的岩石之一,主要由辉石(主要成分硅酸盐)和钛铁矿(主要成分 )等组成。回答下列问题:
)等组成。回答下列问题:
(1)基态铁原子的价电子排布式为:___________ 。
(2)与Fe同周期,且最外层电子数相同的主族元素是___________ (填元素符号)。
(3)基态Ti原子核电子占据的最高能层符号为___________ ;其最外层电子的电子云轮廓图为___________ 。
(4) 中含有
中含有 键数为
键数为___________ , 中配体为
中配体为___________ ,其中C原子的杂化轨道类型为___________ ,H、C、N、Si四种元素的电负性由大到小的顺序为___________ 。
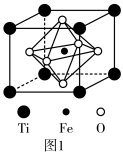
(5) 的结构如图1所示,其中由O围成的
的结构如图1所示,其中由O围成的___________ (填“四面体空隙”或“八面体空隙”)被Fe占据,Ti的配位数为___________ 。
(6)已知该晶胞的密度为 ,
, 表示阿伏加德罗常数的值。计算晶胞参数a=
表示阿伏加德罗常数的值。计算晶胞参数a=___________ pm。(列出计算表达式)
 )等组成。回答下列问题:
)等组成。回答下列问题:(1)基态铁原子的价电子排布式为:
(2)与Fe同周期,且最外层电子数相同的主族元素是
(3)基态Ti原子核电子占据的最高能层符号为
(4)
 中含有
中含有 键数为
键数为 中配体为
中配体为(5)
 的结构如图1所示,其中由O围成的
的结构如图1所示,其中由O围成的
(6)已知该晶胞的密度为
 ,
, 表示阿伏加德罗常数的值。计算晶胞参数a=
表示阿伏加德罗常数的值。计算晶胞参数a=
您最近一年使用:0次
8 . C、S、Cr、Cu及其化合物在化工、材料等方面应用十分广泛。回答下列问题:
(1)二甲基亚砜(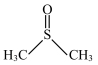 )所含元素的电负性由大到小的顺序为
)所含元素的电负性由大到小的顺序为_______ 。所含碳原子和硫原子的杂化类型分别为_______ 、_______ 。
(2)25℃时,顺-丁烯二酸( )和反-丁烯二酸(
)和反-丁烯二酸(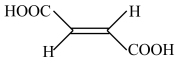 )的电离平衡常数如下表。
)的电离平衡常数如下表。
结合氢键,分析顺-丁烯二酸的K1明显大于反-丁烯二酸的原因是_______ 。
(3)元素Cr位于元素周期表中_______ 区,其基态原子次外层电子数目为_______ 个,其基态原子价层电子的空间运动状态有_______ 种。
(4)某晶体晶胞结构如图所示,其中Cu均匀分散在立方体内,NA为阿伏加德罗常数的值。

①该化合物中铜粒子的价电子排布式为_______ ,a、b氧粒子的坐标参数依次为(0,0,0)、( ,
, ,
, ),则d点粒子的坐标参数为
),则d点粒子的坐标参数为_______ 。
②若a、b间的距离=xcm,计算该晶胞的密度_______ g/cm3(写表达式)。
(1)二甲基亚砜(
 )所含元素的电负性由大到小的顺序为
)所含元素的电负性由大到小的顺序为(2)25℃时,顺-丁烯二酸(
 )和反-丁烯二酸(
)和反-丁烯二酸( )的电离平衡常数如下表。
)的电离平衡常数如下表。| 物质 | 电离平衡常数 | |
| 顺-丁烯二酸 | K1=1.17×10-2 | K2=2.6×10-7 |
| 反-丁烯二酸 | K1=9.3×10-4 | K2=2.9×10-5 |
(3)元素Cr位于元素周期表中
(4)某晶体晶胞结构如图所示,其中Cu均匀分散在立方体内,NA为阿伏加德罗常数的值。

①该化合物中铜粒子的价电子排布式为
 ,
, ,
, ),则d点粒子的坐标参数为
),则d点粒子的坐标参数为②若a、b间的距离=xcm,计算该晶胞的密度
您最近一年使用:0次
名校
解题方法
9 . 下表为长式周期表的一部分其中的编号代表对应的元素。
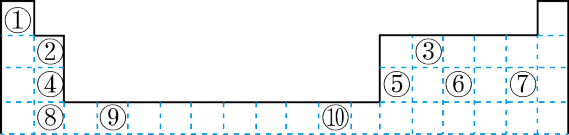
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为___________ ,其中元素③的基态原子的电子排布图为_______ ;①和⑥形成的一种常见四原子分子的化学式为_______ ,该分子的立体构型为______ 。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程___________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
您最近一年使用:0次
解题方法
10 . 化合物F是一种重要的有机合成中间体,某研究小组按下列路线进行合成:
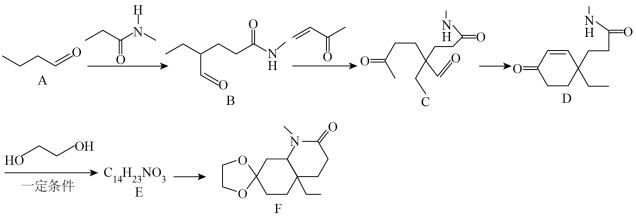
已知: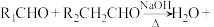
请回答下列问题:
(1)有机物B所含的官能团名称是___________ ,B→C的反应类型为___________ 。
(2)化合物E的结构简式是___________ 。
(3)写出D→E的化学方程式:___________ 。
(4)1分子有机物F分子中含有的手性碳原子数为___________ 。
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为___________ ,第一电离能最大的为___________ (填元素符号)。
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:___________ (任写一种)。
①IR谱检测表明:分子中含有一个苯环,有 键,无
键,无 、
、 键。
键。
② 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。
③仅含有两种官能团,其中一种为 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。

已知:
请回答下列问题:
(1)有机物B所含的官能团名称是
(2)化合物E的结构简式是
(3)写出D→E的化学方程式:
(4)1分子有机物F分子中含有的手性碳原子数为
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:
①IR谱检测表明:分子中含有一个苯环,有
 键,无
键,无 、
、 键。
键。②
 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。③仅含有两种官能团,其中一种为
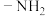 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。
您最近一年使用:0次



