名校
解题方法
1 . 甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1) 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
___________ H(填“>”“<”或“=”), 分子的空间结构为
分子的空间结构为___________ 。
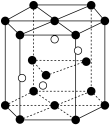
(2)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。

①碳化硅晶体中每个 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为________ , 的晶体类型是
的晶体类型是_______ 。
②基态 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为___________ 。
(3)利用 与
与 可制得氮化硅(
可制得氮化硅(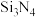 )材料。
)材料。
①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
② 中
中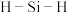 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)
 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
 分子的空间结构为
分子的空间结构为(2)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
①碳化硅晶体中每个
 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为 的晶体类型是
的晶体类型是②基态
 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为(3)利用
 与
与 可制得氮化硅(
可制得氮化硅(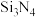 )材料。
)材料。①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
 中
中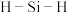 的键角
的键角 中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是
您最近一年使用:0次
名校
解题方法
2 . 铬是一种应用广泛的金属材料。请回答下列问题:
(1)基态铬的价电子排布式为_____________ ,其单电子数目为______________ 。
(2)Cr(NH3)3F3中所含非金属元素的电负性由大到小的顺序是_______________ 。
(3)NH3中N的价层电子对数为____________ ,已知Cr(NH3)3F3中Cr的配位数为6,Cr的配位原子是_____________ ,NH3与Cr3+成键后,N的杂化类型为 ____________ 。
(4)Cr(NH3)3F3固体易升华,其熔沸点均较NaCl 低很多,其原因是________________ 。
(5)将Cr(NH3)3F3在充足氧气中灼烧有Cr2O3生成,从Cr2O3晶体中取出的具有重复性的六棱柱结构如图所示,已知Cr2O3的摩尔质量为Mg/mol,晶体的密度为ρg/cm3,六棱柱的体积为Vcm3。六棱柱结构内部的小白球代表________ (填“铬离子”或“氧离子”)阿伏加 德罗常数NA =___________ mol-1(用含M,V,ρ的代数式表示)。
(1)基态铬的价电子排布式为
(2)Cr(NH3)3F3中所含非金属元素的电负性由大到小的顺序是
(3)NH3中N的价层电子对数为
(4)Cr(NH3)3F3固体易升华,其熔沸点均较NaCl 低很多,其原因是
(5)将Cr(NH3)3F3在充足氧气中灼烧有Cr2O3生成,从Cr2O3晶体中取出的具有重复性的六棱柱结构如图所示,已知Cr2O3的摩尔质量为Mg/mol,晶体的密度为ρg/cm3,六棱柱的体积为Vcm3。六棱柱结构内部的小白球代表

您最近一年使用:0次
2020-04-18更新
|
613次组卷
|
5卷引用:四川省眉山市2020届高三第三次诊断性考试理综化学试题
名校
解题方法
3 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(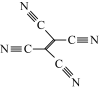 )。
)。
①CH3CN中碳原子的杂化方式是____ 和_____ 。
②TCNE中第一电离能较大的是___ (填元素符号),分子中所有原子____ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为___ (列出计算式)g·cm-3。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为
您最近一年使用:0次
2020-04-06更新
|
624次组卷
|
4卷引用:河南等省五岳2020届高三4月联考(全国I卷)理综化学试题
河南等省五岳2020届高三4月联考(全国I卷)理综化学试题河南省临颍县南街高级中学2020届高三下学期第一次月考理综化学试题江西省九江市十校2020届高三下学期模拟考试理综化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
解题方法
4 . I.非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种
(2) 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3) 中
中 的杂化类型是
的杂化类型是___________ ; 分子的空间结构为
分子的空间结构为___________ 。
(4) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) ,原因是
,原因是___________ 。
II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是___________ 。
A.轨道处于半充满时体系总能量低,核外电子排布应为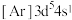
B.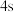 电子能量较高,总是在比
电子能量较高,总是在比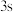 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)
 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)
 中
中 的杂化类型是
的杂化类型是 分子的空间结构为
分子的空间结构为(4)
 的熔、沸点
的熔、沸点 ,原因是
,原因是II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为
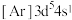
B.
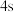 电子能量较高,总是在比
电子能量较高,总是在比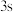 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
您最近一年使用:0次
名校
解题方法
5 . X、Y、Z、M、Q、R是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如表所示:
回答下列问题。
(1)X与Q的电负性大小顺序为___________ (用元素符号表示)。
(2)Y元素基态原子的简化电子排布式为___________ ;R元素基态原子的价层电子轨道表示式为___________ 。
(3)R元素可形成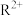 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(4)Y、Z的电负性较大的是___________ (填元素符号)。
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:___________ 。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期主族元素中最大 |
| M | 逐级电离能(单位: )依次为578、1817、2745、11575、14830、18376、23293 )依次为578、1817、2745、11575、14830、18376、23293 |
| Q | 基态原子的核外电子占据5个能级,且最外层p轨道上有2个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子3d能级上有6个电子 |
(1)X与Q的电负性大小顺序为
(2)Y元素基态原子的简化电子排布式为
(3)R元素可形成
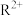 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(4)Y、Z的电负性较大的是
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:
您最近一年使用:0次
解题方法
6 . Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高频、大功率和抗辐射等优点。请回答:
(1)Ga的第一电离能失去的是___________ 能级的电子。
(2)B、C、N的电负性由大到小排列为___________ 。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H-N=C=S),其原因是___________ 。
(4)卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为___________ ;I 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为___________ 。
(5)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为___________ 。
(6)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为___________ (填序号)。
III.金属铁是生活中最常见的金属,其晶胞为体心立方堆积。
(7)其晶胞的俯视图为____ (填字母序号)。
(8)若铁的密度为a g/cm3,则铁晶胞中最近的两个铁原子的核间距离是____ pm(列表达式即可)。
(1)Ga的第一电离能失去的是
(2)B、C、N的电负性由大到小排列为
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H-N=C=S),其原因是
(4)卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为
 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(5)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为
(6)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为
III.金属铁是生活中最常见的金属,其晶胞为体心立方堆积。
(7)其晶胞的俯视图为____ (填字母序号)。
A. | B. | C.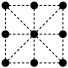 | D. |
您最近一年使用:0次
2021-05-07更新
|
479次组卷
|
3卷引用:吉林省吉林市普通中学2021届高三下学期第四次调研测试理综化学试题
吉林省吉林市普通中学2021届高三下学期第四次调研测试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题河南省名校联盟2022届高三下学期第一次模拟理科综合化学试题
名校
解题方法
7 . 原子序数小于等于36的Q、W、X、Y、Z五种元素,其中Q是形成化合物种类最多的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是______ 。
(2)1molQWX与1molWQ2Y所含σ键的比值为______ 。
(3)根据等电子体理论可以预测WXY-的空间构型为______ 。
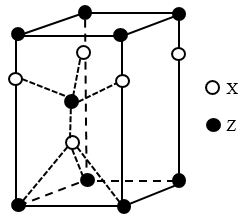
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为______ 。
(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。______ 。
②该化合物所属晶体类型为______ 晶体,预测其熔点应______ 金刚石(填“高于”或“低于”)。
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是
(2)1molQWX与1molWQ2Y所含σ键的比值为
(3)根据等电子体理论可以预测WXY-的空间构型为
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。
②该化合物所属晶体类型为
您最近一年使用:0次
2021-03-14更新
|
326次组卷
|
3卷引用:江苏省如皋中学2020届高三阶段检测化学试题
解题方法
8 . 卤族元素是重要的非金属元素,用途广泛。回答下列问题:
(1)卤族元素位于元素周期表___________ 区,其中电负性最大的是___________ (填元素符号)。
(2)基态氟原子核外有___________ 种运动状态不同的电子,其中含有单电子的轨道形状为___________ 。
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性___________ (填“强”或“弱”),原因是___________ 。
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I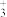 )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。该晶体中不含有的化学键类型为___________ (填选项字母)。
a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为___________ ,晶胞中位置与 K+紧邻的 O 的个数为___________ 。
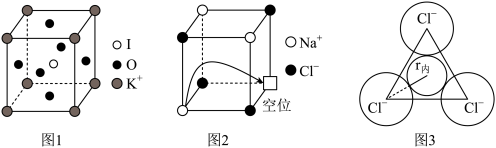
(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确___________ 。(已知: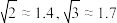 )
)
(1)卤族元素位于元素周期表
(2)基态氟原子核外有
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I
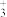 )中心原子的杂化方式为
)中心原子的杂化方式为a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为

(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确
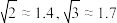 )
)
您最近一年使用:0次
9 . 中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是___ ,基态Zn价电子排布式为___ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为___ 。
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是___ 。
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是___ 。
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为___ 。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为___ 。
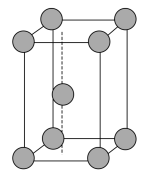
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是___ (用含π的代数式表示)。
(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是

您最近一年使用:0次
10 . B、C、N、O、F是重要的非金属元素,在日常生活和化工生产中有广泛的应用。回答下列问题:
(1)C、N、O的第三电离能由大到小的顺序是_______ ,电负性由大到小的顺序是_______ 。
(2)三氟化硼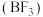 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成
水解生成 和另一种一元无氧酸(甲),甲中B的杂化方式是
和另一种一元无氧酸(甲),甲中B的杂化方式是 ,则甲的化学式是
,则甲的化学式是_______ 。
(3)已知: 中存在大π键:
中存在大π键: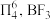 中
中 键的键能是
键的键能是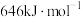 ,而
,而 中
中 键的键能仅
键的键能仅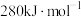 。
。 的分子构型是
的分子构型是_______ ; 中
中 键的键能大于
键的键能大于 中
中 键的键能的原因是
键的键能的原因是_______ 。
(4)亚肼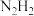 分子中四个原子在同一平面上,有两种结构:
分子中四个原子在同一平面上,有两种结构: 和
和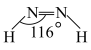 。试推测在水中的溶解度:
。试推测在水中的溶解度:
_______  (填“大于”或“小于”)。
(填“大于”或“小于”)。
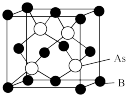
(5)超高热导率半导体材料一砷化硼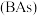 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若该晶体的密度为
,若该晶体的密度为 ,则该晶胞中
,则该晶胞中 原子到B原子的最近距离为
原子到B原子的最近距离为_______  (列出含p、
(列出含p、 的计算式即可)。
的计算式即可)。
(1)C、N、O的第三电离能由大到小的顺序是
(2)三氟化硼
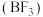 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成
水解生成 和另一种一元无氧酸(甲),甲中B的杂化方式是
和另一种一元无氧酸(甲),甲中B的杂化方式是 ,则甲的化学式是
,则甲的化学式是(3)已知:
 中存在大π键:
中存在大π键: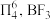 中
中 键的键能是
键的键能是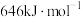 ,而
,而 中
中 键的键能仅
键的键能仅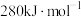 。
。 的分子构型是
的分子构型是 中
中 键的键能大于
键的键能大于 中
中 键的键能的原因是
键的键能的原因是(4)亚肼
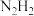 分子中四个原子在同一平面上,有两种结构:
分子中四个原子在同一平面上,有两种结构: 和
和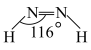 。试推测在水中的溶解度:
。试推测在水中的溶解度:
 (填“大于”或“小于”)。
(填“大于”或“小于”)。(5)超高热导率半导体材料一砷化硼
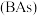 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若该晶体的密度为
,若该晶体的密度为 ,则该晶胞中
,则该晶胞中 原子到B原子的最近距离为
原子到B原子的最近距离为 (列出含p、
(列出含p、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次



