名校
解题方法
1 . 铬是重要的金属元素之一,其化合物有着广泛的用途。
(1)基态铬原子的核外有________ 种空间运动状态不同的电子。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是_______ (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是_______ (填“平面四边形”或“四面体形”)。
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图:

①阴离子中碳原子的杂化轨道类型是_______ 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是________ 。
(4)Cr-N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:
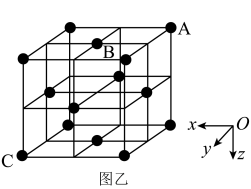
①下列为晶胞中Cr原子沿x轴方向的投影的是________ (填字母)。
a.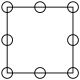 b.
b. c.
c. d.
d.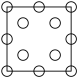
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm;晶胞中N原子的坐标是A(0,0,0)、B( ,
, ,0),则距A和B最近的Cr原子的坐标是
,0),则距A和B最近的Cr原子的坐标是________ ,该原子到C原子的距离是_______ nm(用含a、b的代数式表示)。
(1)基态铬原子的核外有
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图:

①阴离子中碳原子的杂化轨道类型是
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是
(4)Cr-N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:

①下列为晶胞中Cr原子沿x轴方向的投影的是
a.
 b.
b. c.
c. d.
d.
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为anm和bnm;晶胞中N原子的坐标是A(0,0,0)、B(
 ,
, ,0),则距A和B最近的Cr原子的坐标是
,0),则距A和B最近的Cr原子的坐标是
您最近一年使用:0次
2 . 氮的化合物在工业生产中有重要用途,请回答下列问题:
(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N 互为等电子体的分子:
互为等电子体的分子:_______ (填化学式);实验数据表明键角:NH3>PH3>AsH3,分析原因是_______ 。
(2)氮与碳还能形成一种离子液体的正离子 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是_______ 。
(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:
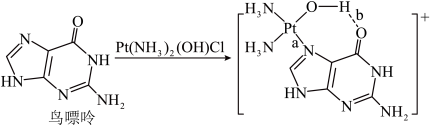
①基态Cu原子价层电子的轨道表示式为_______ ,鸟嘌呤中氮原子的杂化方式为______ 。构成鸟嘌呤的元素电负性由大到小的顺序_______ 。
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-_______ NH3(填“>”或“<”)。
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
请从分子结构角度解释顺铂在水中的溶解度大于反铂的原因是________ 。
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=_______ m3/mol(阿伏加德罗常数为NA)。(已知:单位物质的量的物质所具有的体积叫做摩尔体积)

(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N
 互为等电子体的分子:
互为等电子体的分子:(2)氮与碳还能形成一种离子液体的正离子
 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:

①基态Cu原子价层电子的轨道表示式为
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
| 顺铂 | 反铂 | |
| 结构 |  | 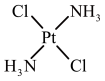 |
| 25℃时溶解度/g | 0.2577 | 0.0366 |
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=

您最近一年使用:0次
3 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图:
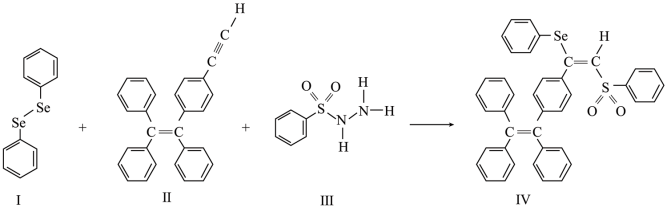
回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为_____ 。
(2)H2Se的沸点低于H2O,其原因是_____ 。
(3)关于I~Ⅲ三种反应物,下列说法正确的有_____ (填字母)。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有_____ (填元素符号)。
(5)硒的两种含氧酸的酸性强弱为H2SeO4_____ H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。SeO 的立体构型为
的立体构型为_____ 。
(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
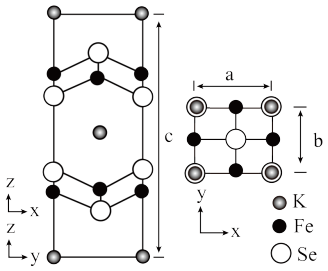
①该超导材料的最简化学式为_____ 。
②Fe原子的配位数为_____ 。
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为_____ g•cm-3(列出计算式)。

回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为
(2)H2Se的沸点低于H2O,其原因是
(3)关于I~Ⅲ三种反应物,下列说法正确的有
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为H2SeO4
 的立体构型为
的立体构型为(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
4 . 光刻技术需要利用深紫激光,我国是唯掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体KBBF(KBe2BO3F2), 实验室可用BeO、KBF4 和B2O3在700°C左右灼烧获得氟代硼铍酸钾晶体(晶胞如下图所示,其中K原子已经给出,氧原子略去),并放出BF3气体。
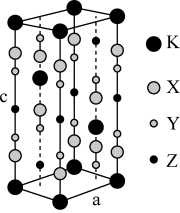
回答下列问题:
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________________ 。
(2)BF3的中心原子的杂化方式为_____________ ,与其互为等电子体的阴离子为__________ (填一种即可)。
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为__________ 。
(4)KBF4的阴离子空间构型为_________ 。
(5)三卤化硼的性质如下:
BF3、BCl3、 BBr3、BI3的沸点逐渐升高的原因是:________________________________ 。
(6)指出图中代表硼原子的字母为_________ ,该KBBF晶体的晶胞参数分别为apm和cpm, α=β=γ=90°, 则晶体密度为___________ g·cm-3(M代表KBBF的摩尔质量,NA表示阿伏伽德罗常数的值,列出计算式)。

回答下列问题:
(1)基态钾原子的核外电子排布式为
(2)BF3的中心原子的杂化方式为
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为
(4)KBF4的阴离子空间构型为
(5)三卤化硼的性质如下:
BF3 | BCl3 | BBr3 | BI3 | |
熔点/°C | -127 | -107 | -46 | 49.9 |
沸点/°C | -99 | 12.5 | 91.3 | 210 |
(6)指出图中代表硼原子的字母为
您最近一年使用:0次
名校
5 . 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近一年使用:0次
2023-04-14更新
|
513次组卷
|
3卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
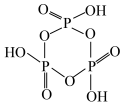
6 . 磷是重要的生命元素之一,存在于细胞、蛋白质、骨骼和牙齿中。回答下列问题:
(1)基态P原子核外电子占据的原子轨道数为___________ 。
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为___________ ,次磷酸(H3PO2)的结构式为___________ ,次磷酸钠中各元素的电负性由大到小的顺序是___________ ,写出一种与PH3互为等电子体的离子___________ (填微粒符号)。
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是___________ 。
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为___________ (用含n的式子表示)。
(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为___________ ,已知该晶体的密度为ρg·cm-3,则最近的Al和P原子间的核间距为___________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。

(1)基态P原子核外电子占据的原子轨道数为
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为

(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为

您最近一年使用:0次
7 . 中国科学家在国际上首次实现了CO2到淀粉的合成,不依赖植物光合作用,原料只需CO2、H2和电,相关成果发表在《科学》上。回答下列问题:
(1)CO2的空间结构为_______ 。
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(3)淀粉在一定条件下可水解成葡萄糖(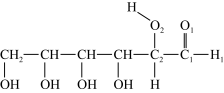 ),葡萄糖分子中键角∠H1C1O1
),葡萄糖分子中键角∠H1C1O1_______ ∠C1C2O2 (填“>”、“<”或“=”)。
(4)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。
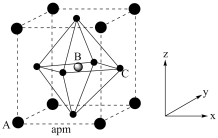
①Pb位于第六周期第IVA族,其基态原子的价电子排布图为_______ ,基态I原子核外电子占据最高能级的电子云轮廓图为_______ 。
②(CH3NH3)PbI3中涉及的短周期元素的电负性由大到小的顺序为_______ (用元素符号表示)。
③有机阳离子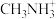 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是_______ 、_______ 。
④_______ (填“A”或“C”)代表I-,原子分数坐标A为(0,0,0),B为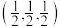 ,则C的原子分数坐标为
,则C的原子分数坐标为_______ 。NA为阿伏加德罗常数的值,则(CH3NH3)PbI3晶体的密度为_______ g∙cm-3。
(1)CO2的空间结构为
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(3)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角∠H1C1O1
),葡萄糖分子中键角∠H1C1O1(4)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。

①Pb位于第六周期第IVA族,其基态原子的价电子排布图为
②(CH3NH3)PbI3中涉及的短周期元素的电负性由大到小的顺序为
③有机阳离子
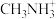 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是④
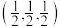 ,则C的原子分数坐标为
,则C的原子分数坐标为
您最近一年使用:0次
解题方法
8 . B和Ni均为新材料的主角。回答下列问题:
(1)基态B原子的核外电子有____ 种空间运动状态;基态Ni原子核外占据最高能层电子的电子云轮廓图的形状为____ 。
(2)硼的卤化物的沸点如表所示:解释表中卤化物之间沸点差异的原因____ 。
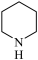
(3)镍可做许多有机物与氢气加成的催化剂,例如吡啶(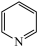 )的反应方程式为:3H2+
)的反应方程式为:3H2+
 ,吡啶中大Π键可以表示为
,吡啶中大Π键可以表示为____ 。
(4)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为____ ;Ni(PPh3)2晶体中存在的化学键类型有____ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)鉴定Ni2+的特征反应如图:

在1mol鲜红色沉淀中,含有sp2杂化原子的数目为____ 个(阿伏加德罗常数的值为NA)。丁二酮肟中,各元素电负性由大到小的顺序为____ (用元素符号表示)。
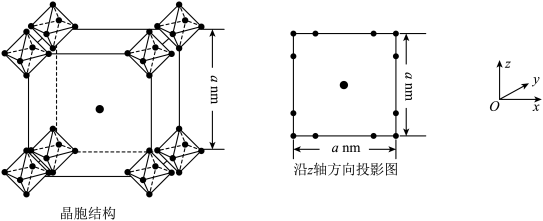
(6)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=____ g•cm-3。
(1)基态B原子的核外电子有
(2)硼的卤化物的沸点如表所示:解释表中卤化物之间沸点差异的原因
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
(3)镍可做许多有机物与氢气加成的催化剂,例如吡啶(
 )的反应方程式为:3H2+
)的反应方程式为:3H2+
 ,吡啶中大Π键可以表示为
,吡啶中大Π键可以表示为(4)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)鉴定Ni2+的特征反应如图:

在1mol鲜红色沉淀中,含有sp2杂化原子的数目为
(6)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=

您最近一年使用:0次
解题方法
9 . 铜是人类广泛使用的一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态Cu原子的价电子排布式为_______ , 原子核外的电子有_______ 种空间运动状态。
(2)配合物Cu(NH3)2OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是_______ ,NH3分子的价层电子对互斥模型是_______ ,C、N、O、H的电负性由大到小的顺序为_______ 。
(3)Cu+与CN-形成的阴离子为[Cu(CN)3]2- ,该阴离子中σ键与π键数目之比为_______ 。
(4)铜能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-C≡N),其原因为_______ 。
(5)某立方磷青铜晶体的晶胞结构如图所示。
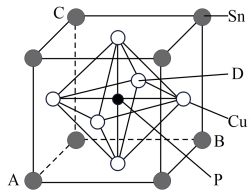
①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为_______ 。
②若晶体密度为ρg·cm-3 ,最近的Cu原子核间距为_______ (用含ρ、NA的代数式表示)pm。
(1)基态Cu原子的价电子排布式为
(2)配合物Cu(NH3)2OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是
(3)Cu+与CN-形成的阴离子为[Cu(CN)3]2- ,该阴离子中σ键与π键数目之比为
(4)铜能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-C≡N),其原因为
(5)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为
②若晶体密度为ρg·cm-3 ,最近的Cu原子核间距为
您最近一年使用:0次
名校
解题方法
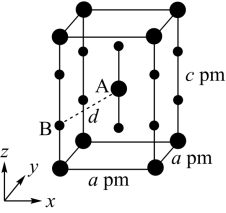
10 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
863次组卷
|
7卷引用:陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题
陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题



