解题方法
1 . 第三代半导体中,碳化硅(SiC)和氮化镓(GaN)是核心半导体。它们具有更宽的禁带宽度、更高的导热率、更高的抗辐射能力、更大的电子饱和漂移速率等特性。
(1)基态Ga原子的价电子排布式为_______ 。
(2)晶体硅、碳化硅、金刚石三种晶体的熔点由高到低的顺序为_______ 。
(3)氮化镓不存在于自然界中,只能通过人工合成来制备,反应为 。
。
①GaCl3熔点为77.9℃,其晶体类型为_______ 。GaF3的熔点为1000℃,则将GaF3熔化时,被破坏的作用力是_______ 。
②上述反应涉及的元素中,电负性最小的是_______ (填元素符号,下同),第一电离能最大的是_______ 。
(1)基态Ga原子的价电子排布式为
(2)晶体硅、碳化硅、金刚石三种晶体的熔点由高到低的顺序为
(3)氮化镓不存在于自然界中,只能通过人工合成来制备,反应为
 。
。①GaCl3熔点为77.9℃,其晶体类型为
②上述反应涉及的元素中,电负性最小的是
您最近一年使用:0次
解题方法
2 . 前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。基态A原子核外电子的L层电子数是K层的2倍;B原子基态时的2p轨道上未成对的电子数最多;C元素为最活泼的非金属元素;D元素核外有3个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
(1)E元素在周期表中位置为_______ ,E3+价电子轨道表示式为_______ 。
(2)B、C、F三种元素电负性由大到小的顺序为_______ (用元素符号表示),第一电离能D_______ (填“>”、“<”或“=”)Al,其原因是_______ 。
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是_______ (填化学式),理由是_______ 。
(4)F元素可能的性质_______ (填标号)。
 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。(1)E元素在周期表中位置为
(2)B、C、F三种元素电负性由大到小的顺序为
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是
(4)F元素可能的性质
| A.其单质可作半导体材料 |
| B.存在-3、+3、+5等多种化合价 |
| C.最高价氧化物对应的水化物是强酸 |
| D.单质还原性弱于磷单质 |
您最近一年使用:0次
2022-04-16更新
|
299次组卷
|
3卷引用:福建省龙岩市一级校联盟(九校)2021-2022学年高二下学期期中联考化学试题
名校
解题方法
3 . 按要求回答下列问题
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_______ 。
②在生成物中,A的电子式_______ ,含极性共价键的分子的中心原子轨道杂化类型为_______ 。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为_______ ,Q2+的未成对电子数是_______ 。
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为_______ 。
②H2Se的酸性比H2S_______ (填“强”或“弱”)。气态SeO3分子的价层电子对互斥模型为_______ ,SeO 离子中Se的杂化方式为
离子中Se的杂化方式为_______ 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为_______ 。
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S
 A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的电子式
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为
②H2Se的酸性比H2S
 离子中Se的杂化方式为
离子中Se的杂化方式为(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为
您最近一年使用:0次
4 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(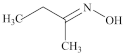 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有___________ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为___________ ,氮原子的杂化方式为___________ ,C=N与C-C键夹角___________ (填“<”“>”或“=”)C=N与N-O键夹角。
(3) 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。
① 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为___________ ,其空间构型为___________ 。
② 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成 ,
, 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因___________ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)
 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。①
 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为②
 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成 ,
, 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因
您最近一年使用:0次
5 . C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)科学家常利用___________ 区分晶体SiO2和非晶体SiO2。
(2)基态Ge原子核外电子的空间运动状态有___________ 种。
(3)Si为重要的半导体材料,硅与NaOH溶液反应生成Na2SiO3溶液,该溶液中四种元素电负性由小到大的顺序为___________ 。硅酸盐中的硅酸根离子通常以[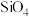 ]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:___________ 。
(4)实验中常用K3[Fe(CN)6]检验Fe2+,K3[Fe(CN)6]中Fe3+的配位数为___________ ,其中碳原子的杂化轨道类型为___________ 。1 mol K3[Fe(CN)6]中含有σ键与π键的数目之比为___________ 。
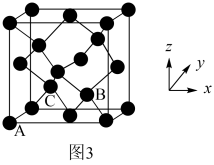
(5)灰锡的晶体结构(如图3所示)与金刚石相似,其中A处原子的原子分数坐标为(0,0,0),则C处原子的原子分数坐标为___________ 。
(1)科学家常利用
(2)基态Ge原子核外电子的空间运动状态有
(3)Si为重要的半导体材料,硅与NaOH溶液反应生成Na2SiO3溶液,该溶液中四种元素电负性由小到大的顺序为
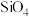 ]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:

(4)实验中常用K3[Fe(CN)6]检验Fe2+,K3[Fe(CN)6]中Fe3+的配位数为
(5)灰锡的晶体结构(如图3所示)与金刚石相似,其中A处原子的原子分数坐标为(0,0,0),则C处原子的原子分数坐标为
您最近一年使用:0次
6 . 2021年5月15日,“天问一号” 火星控测器成功着陆火星。“天问一号”的着陆巡视器突破了高强度铝合金贮箱壳体材料、焊接、250N发动机硅化钼高温抗氧化涂层等多项关键技术,为“天问一号”提供了可靠、精准、稳定的动力。回答下列问题:
(1)钼与铬为同族元素,则钼位于周期表的___________ 区。
(2)铝锂合金是航天飞机低温外贮箱的壳体材料。在合金中加入钪,可大大增加合金的强度。基态钪原子的电子排布式为___________ 。
(3)氢气还原SiHCl3(Si的化合价为+4价),得到高纯硅。将高纯硅和钼高温化合制得硅化钼。SiHCl3的分子空间构型是___________ ;SiHCl3中所含元素电负性由大到小的顺序为___________ 。
(4)火星大气层的主要成分是二氧化碳,其次是氮气、氩气,此外还含有少量的氧气和水蒸气,若将这几种气体降温液化,最先液化的气体是___________ ,原因是___________ 。
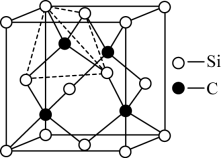
(5)文献报道,硅化钼涂层可提高碳化硅电热元件高温抗氧化性能,SiC的晶胞结构如图所示。晶体中硅原子的配位数为___________ 。图中晶胞含有硅原子数为___________ 。
(1)钼与铬为同族元素,则钼位于周期表的
(2)铝锂合金是航天飞机低温外贮箱的壳体材料。在合金中加入钪,可大大增加合金的强度。基态钪原子的电子排布式为
(3)氢气还原SiHCl3(Si的化合价为+4价),得到高纯硅。将高纯硅和钼高温化合制得硅化钼。SiHCl3的分子空间构型是
(4)火星大气层的主要成分是二氧化碳,其次是氮气、氩气,此外还含有少量的氧气和水蒸气,若将这几种气体降温液化,最先液化的气体是
(5)文献报道,硅化钼涂层可提高碳化硅电热元件高温抗氧化性能,SiC的晶胞结构如图所示。晶体中硅原子的配位数为

您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
②Co2+的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是___________ 。
(4)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为___________ 。
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为___________ (用含a和ρ的最简代数式表示)
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为
②Co2+的最高能层电子排布式为
③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为
 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是(4)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为
您最近一年使用:0次
解题方法
8 . Al、Fe、Cu是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为___ 。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],沸点102.8℃,熔点-21℃,羰基铁[Fe(CO)5]属于___ 晶体。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是原子___ (填名称)。
(3)已知Al的第一电离能为578 kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因___ 。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是___ ;SiO2中Si原子采取___ 杂化。
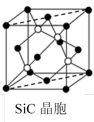
(5)金刚砂(SiC)晶胞如图所示:
沿晶胞图中虚线方向的切面图为___ (填标号)。
a.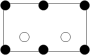 b.
b.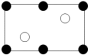
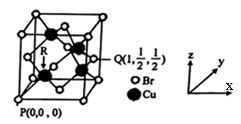
(6)一种铜的溴化物晶胞结构如图所示,该晶胞中铜的配位数是___ ,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为___ ;已知晶胞参数为a pm,其密度为___ g/cm3。(列出计算式即可)
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],沸点102.8℃,熔点-21℃,羰基铁[Fe(CO)5]属于
(3)已知Al的第一电离能为578 kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是
(5)金刚砂(SiC)晶胞如图所示:

沿晶胞图中虚线方向的切面图为
a.
 b.
b.
(6)一种铜的溴化物晶胞结构如图所示,该晶胞中铜的配位数是

您最近一年使用:0次
解题方法
9 . 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。
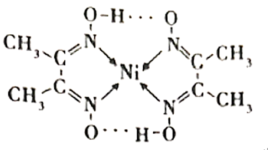
①基态Ni原子的电子排布式为___________ ,该元素在元素周期表中的位置是___________ 。
②元素C、N、O的电负性由大到小顺序为___________ 。
③二丁二酮肟合镍中存在的化学键有___________ (填标号)。
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为___________ 。
(2)工业上采用反应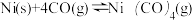 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有___________ 个δ键。
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。
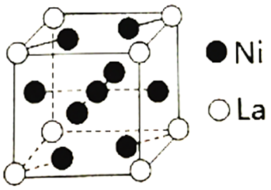
①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为___________ g·cm-3。
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为___________ 。
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。

①基态Ni原子的电子排布式为
②元素C、N、O的电负性由大到小顺序为
③二丁二酮肟合镍中存在的化学键有
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为
(2)工业上采用反应
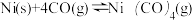 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。

①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为
您最近一年使用:0次
解题方法
10 . 磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为___________ ;价电子中成对电子数有___________ 个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是___________ 。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___________ H3PO4 (填“>”或“<”)
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn___________ P。(填“>”、“<”或 “=”)
(4)某磷青铜晶胞结构如图所示。
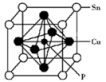
①则其化学式为___________ 。
②该晶体中距离Cu原子最近的Sn原子有___________ 个,这些Sn原子所呈现的构型为___________ 。
(1)基态铜原子的电子排布式为
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn
(4)某磷青铜晶胞结构如图所示。

①则其化学式为
②该晶体中距离Cu原子最近的Sn原子有
您最近一年使用:0次



