(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是
(3)噻吩(
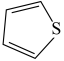 )和吡咯(
)和吡咯(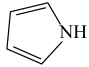 )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为
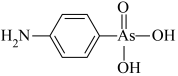
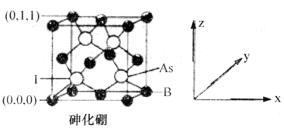
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
 ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为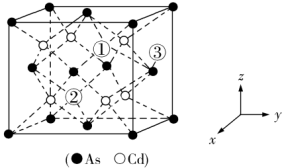
(1)基态氮原子的电子轨道排布式是
(2)C、N、O三种元素第一电离能从小到大的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是
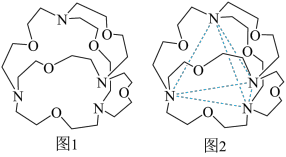
a.CF4 b.NH
 c.H2O d.CH4
c.H2O d.CH4(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是
(1)镍元素位于周期表第
(2)在CO分子中,C与O之间形成
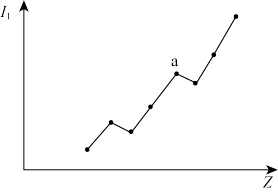
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是
②NH3、PH3、AsH3中沸点最高的是
(1)基态50Sn原子的价电子排布式为
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为
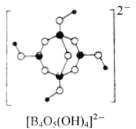
a.氢键 b.离子键 c.共价键 d.配位键
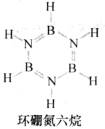
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为
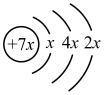 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(3)D的氢化物比C的氢化物的沸点高,原因
(4)E元素在周期表的第
(5)B、C最高价氧化物的晶体类型是分别是
(1)G的元素名称为
(2)A、B、C三种元素电负性由大到小的顺序为
(3)E3+的离子符号为
(4)F元素基态原子的电子排布式为
(5)G元素可能的性质
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小
7 . 2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF—31a洲际战略导弹是我国大国地位,国防实力的显著标志,其制作材料中包含了Fe、Cr、Ni、C等多种元素,回答下列问题:
①基态铬原子的价电子排布式为
②Fe和Ni都能与CO形成配合物Fe(CO)5和Ni(CO)4。
(i)电负性比较:C
(ii)写出与CO互为等电子体的分子的电子式
(iii)Ni(CO)4的沸点为43℃,Fe(CO)5的沸点为103℃,请说明Fe(CO)5沸点更高的原因:
③金刚石晶胞如图所示,A、B坐标参数分别为A(0,0,0),B(1,1,1),则距离A位置最近的原子坐标参数为

④Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别是Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为
(1)在基态Ti原子中,核外存在
(2)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2

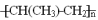 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(3)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是
(4)科学家通过X射线探明一种氮化钛的晶体与NaCl的晶体结构相似。氮化钛熔点(2950℃)比氯化钠的高,主要原因是
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为
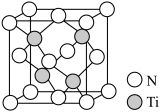
(1)D元素在周期表中的位置为
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是
(3)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是
A.中心原子的价层电子对数目相等B.都是非极性分子C.中心原子的孤电子对数目相等D.都含有极性键E.都能与Na2O反应F.固态时晶体类型不同
(4)D在空气中燃烧的产物分子构型为

(1)I的最高化合价为
(2)基态时Q元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为
(6)元素B和C的气态氢化物热稳定性较强的是
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为



