名校
解题方法
1 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为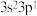 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
解题方法
2 . 恩格列净是治疗2型糖尿病的一种原料药,其关键中间体(F)的合成路线如下:
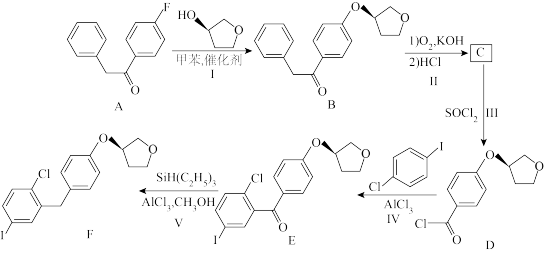
已知: +RCOOH
+RCOOH
回答下列问题:
(1)B分子含有的官能团名称为
(2)反应Ⅰ在
(3)反应Ⅱ生成两种有机物,一种为C,另一种产物的结构简式为
(4)
 易水解:
易水解: 。反应Ⅲ的化学方程式为
。反应Ⅲ的化学方程式为(5)V的反应类型为
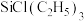 ,若反应中Si的化合价不变,则
,若反应中Si的化合价不变,则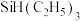 中三种元素按电负性由大到小排列为
中三种元素按电负性由大到小排列为(6)芳香族化合物G是C的同分异构体,请写出符合下列条件的G的结构简式
①能与 溶液反应产生气体
溶液反应产生气体
②核磁共振氢谱有四组峰且峰面积比为6∶3∶2∶1。
您最近一年使用:0次
名校
3 . 表格为门捷列夫元素周期表的一部分,其中的编号代表对应的元素。用元素符号回答下列问题:
(1)基态F原子有___________ 种运动状态的电子。
(2)元素③⑪电负性较大的是___________ ;Se的原子结构示意图为___________ 。
(3)元素铬的基态原子的价电子排布图为:___________ 。
(4)Cu基态原子中,能量最高的电子占据的原子轨道的形状为___________ 。
(5)该表格中电负性最大的元素与第一电离能最小的元素形成的化合物的电子式为________ 。
(6)②③的简单气态氢化物中较稳定的是___________ (填化学式),元素⑥⑦的最高价氧化物的水化物相互反应的离子方程式为___________ 。
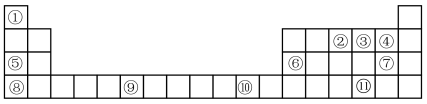
(1)基态F原子有
(2)元素③⑪电负性较大的是
(3)元素铬的基态原子的价电子排布图为:
(4)Cu基态原子中,能量最高的电子占据的原子轨道的形状为
(5)该表格中电负性最大的元素与第一电离能最小的元素形成的化合物的电子式为
(6)②③的简单气态氢化物中较稳定的是
您最近一年使用:0次
2023-09-16更新
|
254次组卷
|
2卷引用:福建省龙岩市连城县第一中学2022-2023学年高二下学期3月月考化学试题
解题方法
4 . 钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)Ti(BH4)3是一种储氢材料。BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为___ ;Ti、B、H元素的电负性由大到小排列顺序为_____ 。
(2)已知Ti3+易形成多种配合物,[TiCl(H2O)5]Cl2·H2O是其中的一种。
①1mol该配合物中含有_______ molσ键。
②Ti3+具有较强还原性的原因是___________ 。
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-xNy,能使TiO2对可见光具有活性,反应如图所示。
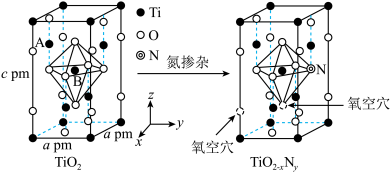
①上图TiO2晶胞中钛原子占据___________ 个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
, ,
, ),则A点原子的分数坐标为(
),则A点原子的分数坐标为( ,0,
,0,___________ )。
③TiO2-xNy晶体中x=___________ 。
(1)Ti(BH4)3是一种储氢材料。BH
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为(2)已知Ti3+易形成多种配合物,[TiCl(H2O)5]Cl2·H2O是其中的一种。
①1mol该配合物中含有
②Ti3+具有较强还原性的原因是
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-xNy,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为(
 ,
, ,
, ),则A点原子的分数坐标为(
),则A点原子的分数坐标为( ,0,
,0,③TiO2-xNy晶体中x=
您最近一年使用:0次
5 . 实验室用邻二氮菲(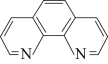 )与
)与 形成的红色配合离子(图1)测定
形成的红色配合离子(图1)测定 的浓度。回答下列问题:
的浓度。回答下列问题:

(1)Fe元素在周期表中的位置为__________ ,该配合物中心离子的配位数为__________ 。
(2)该配合离子所含元素的电负性最大的是__________ ,C原子的杂化方式为__________ 。
(3)该配合离子存在的化学键类型有__________ 。
a.离子键 b.配位键 c.极性键 d.非极性键 e.金属键 f.氢键
(4)从结构角度分析, 易被氧化成
易被氧化成 的原因是
的原因是__________ 。
(5)合成氨反应中铁催化剂表面吸附氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图,图中铁原子与氮原子的个数比为__________ 。
(6)铁晶体中的原子堆积方式如图3所示, 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为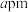 ,若晶胞密度为
,若晶胞密度为 ,则
,则
__________ (列出表达式)。
 )与
)与 形成的红色配合离子(图1)测定
形成的红色配合离子(图1)测定 的浓度。回答下列问题:
的浓度。回答下列问题:
(1)Fe元素在周期表中的位置为
(2)该配合离子所含元素的电负性最大的是
(3)该配合离子存在的化学键类型有
a.离子键 b.配位键 c.极性键 d.非极性键 e.金属键 f.氢键
(4)从结构角度分析,
 易被氧化成
易被氧化成 的原因是
的原因是(5)合成氨反应中铁催化剂表面吸附氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图,图中铁原子与氮原子的个数比为
(6)铁晶体中的原子堆积方式如图3所示,
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为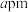 ,若晶胞密度为
,若晶胞密度为 ,则
,则
您最近一年使用:0次
名校
解题方法
6 . 2023年1月30日,中国科学院朱庆山团队研究六方相砷化镍(NiAs)型到正交相磷化锰(MnP)型结构转变,实现了对锂硫催化剂的精确设计。回答下列问题:
(1)Li、P、S三种元素中,电负性最小的是___________ 。第三周期元素中第一电离能比P大的元素有___________ 种。
(2)基态As原子的电子排布式为___________ 。
(3)PH3、AsH3中沸点较高的是___________ ,其主要原因是___________ 。
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为___________ 。
(5)等物质的量的CH3CN和CO中,π键数目之比___________ 。
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρg/cm3,则该晶胞中最近的砷原子之间的距离为___________ pm。
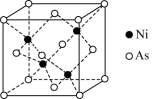
(1)Li、P、S三种元素中,电负性最小的是
(2)基态As原子的电子排布式为
(3)PH3、AsH3中沸点较高的是
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为
(5)等物质的量的CH3CN和CO中,π键数目之比
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρg/cm3,则该晶胞中最近的砷原子之间的距离为

您最近一年使用:0次
7 . Ⅰ.已知A、B、C、D、E、F、G、H8种短周期元素的原子半径和某些化合价如下表所示:
(1)将D、F两种元素的元素符号填入如图所示元素周期表中的相应位置_______ 。
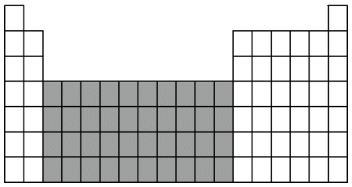
(2)上图中阴影部分所示区域的元素称为_______ 元素,下列元素属于该区域的是_______ 。
A.Ba B.Fe C.Br D.Rb
Ⅱ.现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(3)G2D2的电子式为_______ 。(D、G为字母代号,请将字母代号用元素符号表示,下同)。
(4)某同学推断E元素基态原子的核外电子轨道表示式为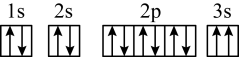 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了_______ ,该元素的I3远远大于I2,其原因是_______ 。
(5)D、E、F三种元素的简单离子半径由大到小的顺序是_______ 。
(6)H位于元素周期表中_______ 区(按电子排布分区),其基态原子的价电子排布式为_______ 。与元素H位于同一周期,其原子基态时未成对电子数在同周期中最多的元素是_______ (填元素符号)。
(7)写出一种由A、B、C、D四种元素组成离子化合物_______ 。
(8)GeO2不能形成类似CO2分子中的π键,原因是_______ 。
| 元素 | A | B | C | D | E | F | G | H |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 | +7、-1 | +4、-4 |
| 原子半径/nm | 0.073 | 0.075 | 0 077 077 | 0.102 | 0 130 130 | 0.154 | 0 099 099 | 0.111 |

(2)上图中阴影部分所示区域的元素称为
A.Ba B.Fe C.Br D.Rb
Ⅱ.现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素是形成化合物种类最多的元素 |
| C元素基态原子的核外p能级电子数比s能级电子数少1 |
| D元素基态原子的核外p轨道中有两个未成对电子 |
| E元素的气态基态原子的第一至第四电离能分别是I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol |
| F元素的主族序数与周期数的差为4 |
| G元素是前四周期中电负性最小的元素 |
| H元素位于元素周期表中的第8列 |
(4)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了(5)D、E、F三种元素的简单离子半径由大到小的顺序是
(6)H位于元素周期表中
(7)写出一种由A、B、C、D四种元素组成离子化合物
(8)GeO2不能形成类似CO2分子中的π键,原因是
您最近一年使用:0次
名校
解题方法
8 . 翡翠是玉石中的一种,其主要成分为NaAlSi2O6,常含微量Cr、Ni、Mn、Fe、Mg等元素,其中Cr3+的含量决定其绿色的深浅,是决定翡翠品质的重要因素之一。
(1)基态硅原子的核外电子排布式为___________________ 。
(2)NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________ (写电子式)。
(3)硅与碳类似,能与氢元素形成SiH4、Si2H4、Si3H8,此三种分子中硅原子为sp3杂化的有_______ ;Si2H4分子的空间构型是___________ 。
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:_________
(5)已知某FeSO4·xH2O的结构如图所示。
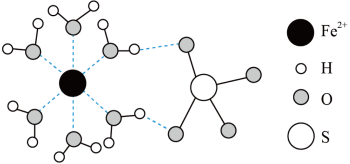
粒子内部的键角SO
_______ H2O(填“>”“<”或“=”),从杂化类型及斥力大小角度说明判断的理由:_______________ 。
(6)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+、O2-采用面心立方最密堆积方式。
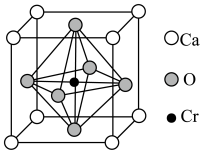
①该晶体的化学式为_______ 。
②已知钙离子、氧离子半径分别为100pm、140pm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________ pm。
(1)基态硅原子的核外电子排布式为
(2)NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是
(3)硅与碳类似,能与氢元素形成SiH4、Si2H4、Si3H8,此三种分子中硅原子为sp3杂化的有
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:
(5)已知某FeSO4·xH2O的结构如图所示。

粒子内部的键角SO

(6)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+、O2-采用面心立方最密堆积方式。

①该晶体的化学式为
②已知钙离子、氧离子半径分别为100pm、140pm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
名校
解题方法
9 . 中国科学家首次在月球上发现新矿物,将其命名为“嫦娥石”,“嫦娥石”中包含了Fe、Cu、Ti、Cr、Ni、Mo、N、O等多种元素。
(1)鉴定月球土壤的元素组成,可采用的方法是___________ 。
A.光谱分析 B.X-射线衍射分析
(2)在第二周期中,第一电离能比N高的主族元素是___________ 。氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填序号)。
A.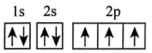 B.
B.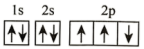
C.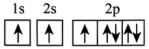 D.
D.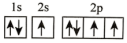
(3)已知有关氮、磷的单键和三键的键能( )如下表:
)如下表:
从能量角度看,氮以 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为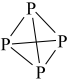 )形式存在的原因是
)形式存在的原因是___________ 。
(4)已知 分子的键角约为107°,而同主族磷的氢化物
分子的键角约为107°,而同主族磷的氢化物 分子的键角约为94°,试用价层电子对互斥模型解释
分子的键角约为94°,试用价层电子对互斥模型解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:___________
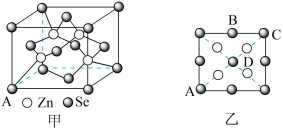
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为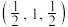 ,则D原子坐标为
,则D原子坐标为___________ ;若该晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为_________________ 。
(1)鉴定月球土壤的元素组成,可采用的方法是
A.光谱分析 B.X-射线衍射分析
(2)在第二周期中,第一电离能比N高的主族元素是
A.
 B.
B.
C.
 D.
D.
(3)已知有关氮、磷的单键和三键的键能(
 )如下表:
)如下表:| N-N |  | P-P |  |
| 193 | 946 | 197 | 489 |
从能量角度看,氮以
 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为 )形式存在的原因是
)形式存在的原因是(4)已知
 分子的键角约为107°,而同主族磷的氢化物
分子的键角约为107°,而同主族磷的氢化物 分子的键角约为94°,试用价层电子对互斥模型解释
分子的键角约为94°,试用价层电子对互斥模型解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为
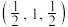 ,则D原子坐标为
,则D原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为
您最近一年使用:0次
10 . 回答下列问题:
(1)下列现象与原子核外电子跃迁有关的是___________ (填序号)。
a.焰火 b.LED灯光 c.金属导电
(2)在周期表中,与Li的化学性质最相似的邻族元素是___________ 。
(3)硼、钛等元素的化合物具有广泛的应用价值。
①B原子中存在未成对电子的能级电子云在空间有___________ 种伸展方向。
② (硼氢化钛)可由
(硼氢化钛)可由 和
和 反应制得。基态钛原子的价层电子轨道表示式为
反应制得。基态钛原子的价层电子轨道表示式为___________ 。电负性大小顺序为H___________ B(填“>”或“<”)。
(4)氮单质及其化合物在研究和生产中有着广泛的应用。
①亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到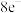 结构,则其电子式为
结构,则其电子式为___________ ,其水解会生成两种酸,写出水解的化学方程式___________ 。
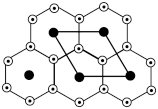
②氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为___________ ;
(1)下列现象与原子核外电子跃迁有关的是
a.焰火 b.LED灯光 c.金属导电
(2)在周期表中,与Li的化学性质最相似的邻族元素是
(3)硼、钛等元素的化合物具有广泛的应用价值。
①B原子中存在未成对电子的能级电子云在空间有
②
 (硼氢化钛)可由
(硼氢化钛)可由 和
和 反应制得。基态钛原子的价层电子轨道表示式为
反应制得。基态钛原子的价层电子轨道表示式为(4)氮单质及其化合物在研究和生产中有着广泛的应用。
①亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到
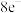 结构,则其电子式为
结构,则其电子式为②氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为

您最近一年使用:0次



