名校
解题方法
1 . 青霉胺可以用于医学上误食铜盐的解毒,解毒原理: 形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法正确的是
形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法正确的是
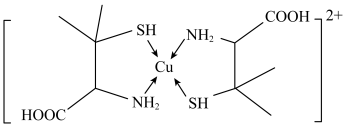
 形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法正确的是
形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法正确的是
A.共价键键角的大小关系为: |
B.电负性大小关系为: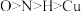 |
| C.该配合物易溶于水的主要原因是其与水可形成分子间氢键 |
D.与铜离子形成配位键强弱的大小关系为: |
您最近一年使用:0次
名校
2 . 类比推理是学习化学的重要的思维方法,下列陈述I及类比推理陈述Ⅱ均正确的是
| 选项 | 陈述I | 类比推理陈述II |
| A | 在空气中加热, 生成 生成 | 在空气中加热, 也生成 也生成 |
| B | 酸性: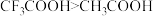 | 碱性: |
| C |  是强酸 是强酸 |  也是强酸 也是强酸 |
| D | 通入 可增强漂白粉溶液漂白性 可增强漂白粉溶液漂白性 | 通入 也可增强漂白粉溶液漂白性 也可增强漂白粉溶液漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 湿法炼锌综合回收系统产出的萃余液中含有Na2SO4、ZnSO4、H2SO4,还含有Mn2+、Co2+、Ni2+、Cd2+、Fe2+、A13+等,一种将萃余液中有价离子分步分离、富集回收的工艺流程如下:

回答下列问题:
(1)“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为___________ 。
(2)“调pH”时,所得滤渣1中除含有MnO2和Fe(OH)3外,还有___________ 。此时若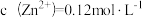 ,pH的范围应为
,pH的范围应为___________ 。{已知:常温下,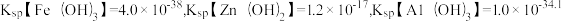 }
}
(3)“除镉”时,发生的反应属于四种基本反应类型的___________ 。
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:
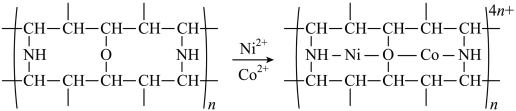
该有机净化剂所含元素的电负性由大到小的顺序为___________ 。上述反应时,接受电子对的一方是___________ 。
(5)“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为___________ 。
(6)“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8,从而实现原料的循环利用,该电解过程中总反应的化学方程式为___________ 。

回答下列问题:
(1)“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为
(2)“调pH”时,所得滤渣1中除含有MnO2和Fe(OH)3外,还有
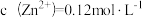 ,pH的范围应为
,pH的范围应为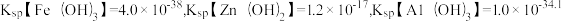 }
}(3)“除镉”时,发生的反应属于四种基本反应类型的
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:

该有机净化剂所含元素的电负性由大到小的顺序为
(5)“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为
(6)“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8,从而实现原料的循环利用,该电解过程中总反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 一种由W、X、Y、Z、Q五种短周期主族元素组成的离子结构如图所示,其中X、Q同主族,Y的基态原子s轨道电子数是p轨道的2倍,且W、X、Z原子序数之和为15.下列说法正确的是
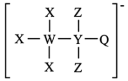
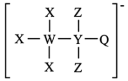
A.电负性: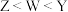 |
B.最高价氧化物对应水化物的酸性: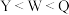 |
C.阴离子还原性: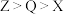 |
| D.X与Z形成的化合物沸点一定高于Y与Z形成的化合物沸点 |
您最近一年使用:0次
名校
5 . 锂一磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: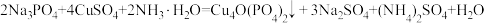 。回答下列问题:
。回答下列问题:
(1)铜位于周期表中_____ 区,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有_____ (填元素符号)。
(2)上述方程式中涉及的N、O、P、S元素第一电离能由小到大的顺序为________ ,电负性由小到大的顺序为______ 。
(3)常见含硫的微粒有SO2、SO3、 等,
等, 的空间构型为
的空间构型为________ ;SO2、SO3杂化轨道类型相同,但键角SO3大于SO2,原因是_______ 。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中σ键与π键的数目之比为_______ 。
(5)铜的晶胞结构如图所示。
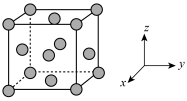
①铜晶胞在x轴方向的投影图是_____ (填标号)。
A.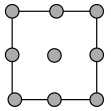 B.
B. 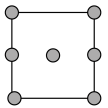
C.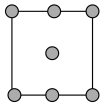 D.
D. 
②假设铜晶胞参数为anm,铜晶体的密度为bg·cm-3,则铜的相对原子质量为_____ (设NA为阿伏加德罗常数的值,用含a、b、NA的代数式表示)。
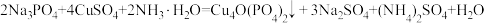 。回答下列问题:
。回答下列问题:(1)铜位于周期表中
(2)上述方程式中涉及的N、O、P、S元素第一电离能由小到大的顺序为
(3)常见含硫的微粒有SO2、SO3、
 等,
等, 的空间构型为
的空间构型为(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中σ键与π键的数目之比为
(5)铜的晶胞结构如图所示。

①铜晶胞在x轴方向的投影图是
A.
 B.
B. 
C.
 D.
D. 
②假设铜晶胞参数为anm,铜晶体的密度为bg·cm-3,则铜的相对原子质量为
您最近一年使用:0次
名校
解题方法
6 . 已知X、Y、Z、W是原子序数依次增大的短周期主族元素,位于三个不同的周期。由X、Y、Z组成的某有机物常用于合成高分子化合物,其结构如图所示。W原子的最外层电子数比Z多。下列说法正确的是
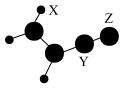

| A.该有机物不能使酸性高锰酸钾溶液褪色 |
| B.电负性:W一定比Z强 |
| C.Z、W的最高价氧化物对应的水化物均为强电解质 |
| D.该有机物分子中碳原子的杂化方式有sp2和sp3两种 |
您最近一年使用:0次
名校
解题方法
7 . X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻,X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确 的是
A.第一电离能: |
B.电负性: |
C.Z、W原子形成稀有气体电子构型的简单离子的半径: |
D.Y与Z形成的分子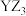 中每个原子均满足 中每个原子均满足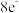 结构 结构 |
您最近一年使用:0次
2024-01-09更新
|
475次组卷
|
3卷引用:海南省农垦中学2023-2024学年高二上学期期中检测化学试题
名校
8 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布式为 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是| A.A、B、C三种元素的电负性:B>C>A |
| B.B、C、D、E四种元素的第一电离能:B>C>E>D |
C.B、C形成的化合物 为酸性氧化物 为酸性氧化物 |
D.F的常见离子的核外电子排布图为 |
您最近一年使用:0次
2024-01-08更新
|
345次组卷
|
7卷引用:四川省成都石室中学2023-2024学年高二上学期期中考试化学试卷
四川省成都石室中学2023-2024学年高二上学期期中考试化学试卷山东省济南市历城第二中学2023-2024学年高二上学期期末化学模拟试题甘肃省武威第七中学2023-2024学年高二上学期期末考试化学试题(已下线)名校期中好题汇编-原子结构与性质(选择题)名校期中好题汇编-原子结构与性质(选择题)(已下线)1.2.2元素周期律-随堂练习(已下线)清单01 原子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
9 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅷ族的元素,其化合物在生产生活中应用广泛。
(1)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示。
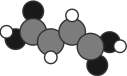
①富马酸亚铁中各元素的电负性由大到小的顺序为_______ 。
②富马酸分子中σ键与π键的数目比为_______ 。
③基态Fe的价层电子中,两种自旋状态的电子数之比为_______ 。
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。

①色胺酮分子中N原子的杂化类型为_______ 。
②X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过_______ 作用与色胺酮钴配合物相结合。
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

①距离Mg原子最近的Ni原子有_______ 个。
②已知该晶体的边长为anm,阿伏加德罗常数的值为NA,该晶体的密度为_______ g·cm-3。
(1)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示。

①富马酸亚铁中各元素的电负性由大到小的顺序为
②富马酸分子中σ键与π键的数目比为
③基态Fe的价层电子中,两种自旋状态的电子数之比为
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。

①色胺酮分子中N原子的杂化类型为
②X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

①距离Mg原子最近的Ni原子有
②已知该晶体的边长为anm,阿伏加德罗常数的值为NA,该晶体的密度为
您最近一年使用:0次
名校
解题方法
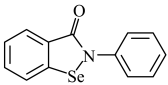
10 . 硒、铁是人体不可缺少的微量元素,它们的化合物在生产、生活中有着广泛的应用。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为___________ 。
(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图所示。分子中元素Se、O、N的第一电离能由大到小的顺序为___________ 。
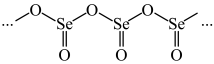
(3)硒的某种氧化物为链状聚合结构(如图),该氧化物的最简式为___________ 。
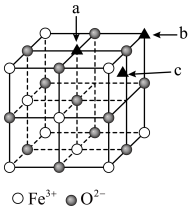
(4) 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置___________ 。
(5)科学家利用 在Fe基催化剂上加氢成功制得甲酸,已知
在Fe基催化剂上加氢成功制得甲酸,已知 (加成反应),
(加成反应), 。根据电负性的相对大小,画出中间体X的结构简式:
。根据电负性的相对大小,画出中间体X的结构简式:______ 。
(6)1183K以下纯铁晶体的基本结构单元如下左图所示,1183K以上转变为如下右图所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
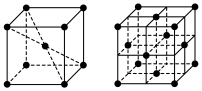
①在1183K以下的纯铁晶体中,铁原子的配位数为___________ 。
②两种晶胞中含铁原子数之比___________ 。
(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图所示。分子中元素Se、O、N的第一电离能由大到小的顺序为

(3)硒的某种氧化物为链状聚合结构(如图),该氧化物的最简式为

(4)
 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置
(5)科学家利用
 在Fe基催化剂上加氢成功制得甲酸,已知
在Fe基催化剂上加氢成功制得甲酸,已知 (加成反应),
(加成反应), 。根据电负性的相对大小,画出中间体X的结构简式:
。根据电负性的相对大小,画出中间体X的结构简式:(6)1183K以下纯铁晶体的基本结构单元如下左图所示,1183K以上转变为如下右图所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。

①在1183K以下的纯铁晶体中,铁原子的配位数为
②两种晶胞中含铁原子数之比
您最近一年使用:0次



