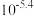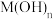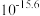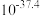名校
1 . 过硫酸钠(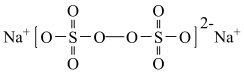 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
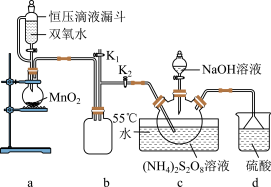
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。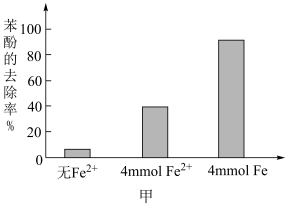
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为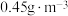 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: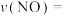
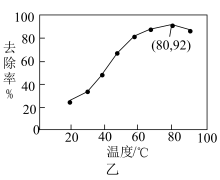
 。
。
您最近一年使用:0次
名校
2 . 硫酸亚铁铵[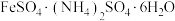 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为___________ 。
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为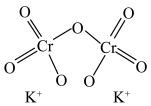 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。
(3)圆底烧瓶中生成 的离子方程式为
的离子方程式为___________ 。
(4)第二步中需要称量剩余铁屑质量的原因为___________ ,写出制备硫酸亚铁铵晶体的化学方程式:___________ 。
(5)试剂N是___________ 。
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。
①重铬酸钾在酸性条件下的还原产物为 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:___________ 。
②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为___________ (写出含M的表达式)。
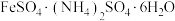 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL
 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。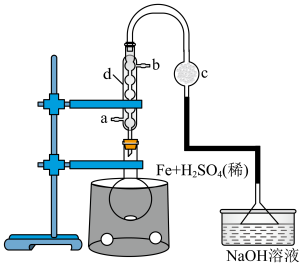
 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为
 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。A. | B. | C. | D.sp |
(3)圆底烧瓶中生成
 的离子方程式为
的离子方程式为(4)第二步中需要称量剩余铁屑质量的原因为
(5)试剂N是
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL
 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。①重铬酸钾在酸性条件下的还原产物为
 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为
您最近一年使用:0次
7日内更新
|
54次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
名校
解题方法
3 . 铋的化合物在电催化和光催化领域都有广泛应用。一种以氧化铋渣(主要成分是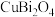 、
、 、
、 和
和 等)为原料,制取高纯
等)为原料,制取高纯 的工业流程如图所示:
的工业流程如图所示:
回答下列问题:
(1)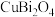 中的Cu的化合价为+2,则Bi的化合价是
中的Cu的化合价为+2,则Bi的化合价是_______ ,Bi与N同族,Bi原子处于基态时电子占据最高能级的电子云轮廓图为_______ 形。
(2)“沉铋”时加入NaOH溶液, 转化为BiOCl沉淀的离子方程式是
转化为BiOCl沉淀的离子方程式是_______ 。
(3)“洗涤”滤饼时先用水洗,再用稀硫酸洗涤(已知:BiOCl不溶于稀硫酸),用稀硫酸洗涤的目的是为了除去滤饼中的_______ (填化学式)杂质。
(4)“转化”过程中BiOCl转化为 沉淀,当溶液中
沉淀,当溶液中 浓度为
浓度为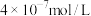 时溶液的pH为
时溶液的pH为_______ 。(该温度下,已知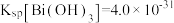 )
)
(5)硫代乙酰胺(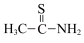 )中碳原子的杂化方式分别为
)中碳原子的杂化方式分别为_______ 。
(6)钼酸铋( )可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为
)可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为 ,晶胞棱边夹角均为90°。
,晶胞棱边夹角均为90°。 ,则原子2的分数坐标为
,则原子2的分数坐标为_______ 。
②设阿伏加德罗常数的值为 ,
, 的相对分子质量为
的相对分子质量为 ,则
,则 晶体的密度为
晶体的密度为_______  。
。
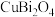 、
、 、
、 和
和 等)为原料,制取高纯
等)为原料,制取高纯 的工业流程如图所示:
的工业流程如图所示: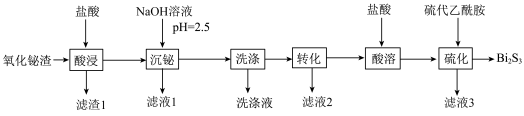
| 离子 |  |  |  |
| 开始沉淀的pH | 1.5 | 3.6 | 4.5 |
| 沉淀完全的pH | 3.2 | 4.7 | 6.7 |
(1)
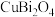 中的Cu的化合价为+2,则Bi的化合价是
中的Cu的化合价为+2,则Bi的化合价是(2)“沉铋”时加入NaOH溶液,
 转化为BiOCl沉淀的离子方程式是
转化为BiOCl沉淀的离子方程式是(3)“洗涤”滤饼时先用水洗,再用稀硫酸洗涤(已知:BiOCl不溶于稀硫酸),用稀硫酸洗涤的目的是为了除去滤饼中的
(4)“转化”过程中BiOCl转化为
 沉淀,当溶液中
沉淀,当溶液中 浓度为
浓度为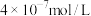 时溶液的pH为
时溶液的pH为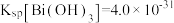 )
)(5)硫代乙酰胺(
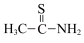 )中碳原子的杂化方式分别为
)中碳原子的杂化方式分别为(6)钼酸铋(
 )可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为
)可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为 ,晶胞棱边夹角均为90°。
,晶胞棱边夹角均为90°。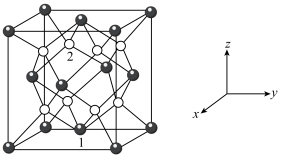
 ,则原子2的分数坐标为
,则原子2的分数坐标为②设阿伏加德罗常数的值为
 ,
, 的相对分子质量为
的相对分子质量为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
名校
4 . 利用高压氨浸法从黄铜矿中提取铜具有提取率高、污染小等优点,被广泛使用。一种由黄铜矿(主要成分为 ,含少量
,含少量 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下:
I.“固液分离”后溶液中主要离子为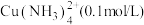 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为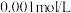 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为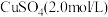 。
。
Ⅱ.不稳定常数对 ,不稳定常数
,不稳定常数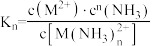
Ⅲ.溶度积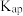
(1)基态 原子的价电子排布式为
原子的价电子排布式为________________ , 中氮原子的杂化方式为
中氮原子的杂化方式为_______________ 。
(2)①浸出前“粉碎磨矿”的目的是_______________ ,②“固液分离”用到的操作是_______________ 。
(3)①“搅拌浸出”主要成分反应的化学方程式为______________ 。(已知:硫元素变成最高价,铁元素变成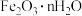 );
);
②铁元素没有以配合物离子存在的原因是__________________ 。
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为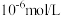 ],需调节
],需调节 至
至___________ ,“萃取”和“反萃取”的作用为________________ 。
 ,含少量
,含少量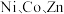 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下: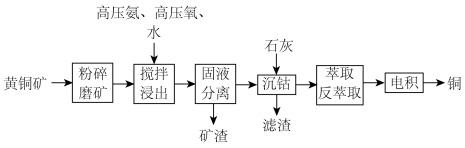
I.“固液分离”后溶液中主要离子为
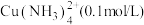 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为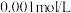 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为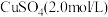 。
。Ⅱ.不稳定常数对
 ,不稳定常数
,不稳定常数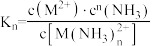
|
|
|
不稳定常数 |
| 0.2 |
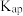
|
|
|
溶度积 |
|
|
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 中氮原子的杂化方式为
中氮原子的杂化方式为(2)①浸出前“粉碎磨矿”的目的是
(3)①“搅拌浸出”主要成分反应的化学方程式为
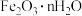 );
);②铁元素没有以配合物离子存在的原因是
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为
 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为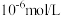 ],需调节
],需调节 至
至
您最近一年使用:0次
名校
解题方法
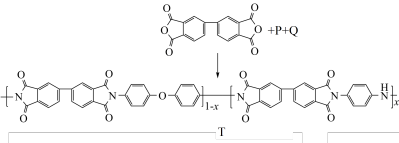
5 . 柔性显示材料M(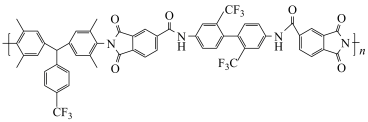 )的合成路线如下:
)的合成路线如下:
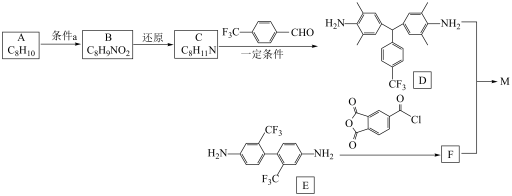
已知:①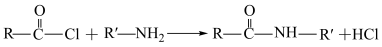
②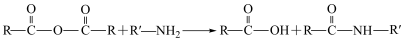
(2)C中所含官能团的名称为
(3)C生成D的反应化学方程式为
(4)E生成F的反应类型为
(5)满足下列条件的B的同分异构体有
①苯环上有三个取代基 ②能与NaOH溶液反应 ③能发生银镜反应
(6)根据合成M的反应原理推断合成T的单体结构简式,P为
您最近一年使用:0次
2024-05-16更新
|
147次组卷
|
2卷引用:2024届重庆市南开中学校高三下学期5月月考化学试题
6 . 氯化亚铜可用作有机合成的催化剂。以黄铜矿(主要成分为 ,还含杂质
,还含杂质 )为主要原料制备
)为主要原料制备 的流程如下。已知:
的流程如下。已知: 可以溶解在氯离子浓度较大的溶液中,生成
可以溶解在氯离子浓度较大的溶液中,生成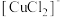 ,
,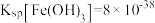 ,
,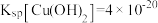 ,
, 。
。___________ (填“大于”或“小于”)锌的第二电离能,其主要原因是___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)用 溶液调节溶液的
溶液调节溶液的 的值应大于
的值应大于___________ 。
(4)“还原”过程中发生的主要反应的离子方程式为___________ ;该过程中若 的用量过多,造成的后果是
的用量过多,造成的后果是___________ 。
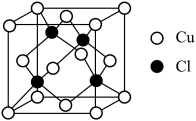
(5)氯化亚铜的立方晶胞如图所示,已知其密度为 ,
, 为阿伏加德罗常数的值,晶胞中
为阿伏加德罗常数的值,晶胞中 的配位数为
的配位数为___________ ,该晶胞参数为___________  。
。
 ,还含杂质
,还含杂质 )为主要原料制备
)为主要原料制备 的流程如下。已知:
的流程如下。已知: 可以溶解在氯离子浓度较大的溶液中,生成
可以溶解在氯离子浓度较大的溶液中,生成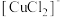 ,
,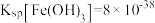 ,
,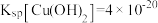 ,
, 。
。
(2)“滤渣1”的主要成分为
(3)用
 溶液调节溶液的
溶液调节溶液的 的值应大于
的值应大于(4)“还原”过程中发生的主要反应的离子方程式为
 的用量过多,造成的后果是
的用量过多,造成的后果是(5)氯化亚铜的立方晶胞如图所示,已知其密度为
 ,
, 为阿伏加德罗常数的值,晶胞中
为阿伏加德罗常数的值,晶胞中 的配位数为
的配位数为 。
。
您最近一年使用:0次
名校
解题方法
7 . 裸蒴入药有清热利湿,消肿利尿,解毒排脓等功效,其抑菌活性成分为化合物 。
。 的合成路线如图:
的合成路线如图:
(1)化合物 (
(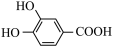 )与A相比,熔点较高的为
)与A相比,熔点较高的为___________ (填字母)。
(2) 为溴代烃,B生成C的化学方程式为
为溴代烃,B生成C的化学方程式为___________ 。
(3)D中碳原子的杂化方式为___________ , 生成
生成 的反应类型为
的反应类型为___________ 。
(4) 中不饱和含氧官能团的名称为
中不饱和含氧官能团的名称为___________ 。
(5) 的结构简式为
的结构简式为___________ 。
(6) 的同分异构体中,含有苯环和碳氧双键且能发生水解反应的有
的同分异构体中,含有苯环和碳氧双键且能发生水解反应的有___________ 个(不考虑立体异构)。其中核磁共振氢谱峰面积之比为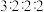 的同分异构体的化学名称为
的同分异构体的化学名称为___________ ,该化合物在盐酸中水解的离子方程式为___________ 。
 。
。 的合成路线如图:
的合成路线如图: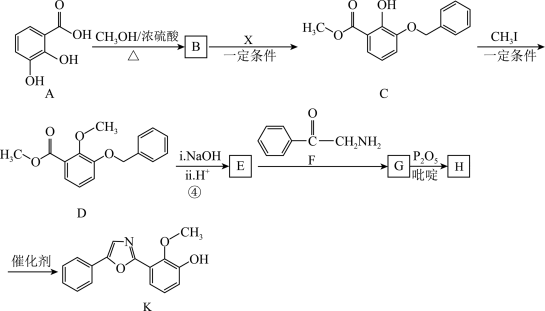
已知:
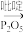
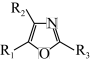
(1)化合物
 (
( )与A相比,熔点较高的为
)与A相比,熔点较高的为(2)
 为溴代烃,B生成C的化学方程式为
为溴代烃,B生成C的化学方程式为(3)D中碳原子的杂化方式为
 生成
生成 的反应类型为
的反应类型为(4)
 中不饱和含氧官能团的名称为
中不饱和含氧官能团的名称为(5)
 的结构简式为
的结构简式为(6)
 的同分异构体中,含有苯环和碳氧双键且能发生水解反应的有
的同分异构体中,含有苯环和碳氧双键且能发生水解反应的有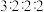 的同分异构体的化学名称为
的同分异构体的化学名称为
您最近一年使用:0次
8 . 下表中A、B、C、D、E为原子序数依次增大的短周期主族元素,F、G为第四周期元素,其相关信息如下:
(1)E元素在周期表中的位置是___________ ,其基态原子最高能层的电子占据的原子轨道电子云为_____________ 形。
(2)F元素位于元素周期的_____________ 区,其基态原子的价层电子轨道表示式为______________ 。
(3)C元素单质的结构式为_____________ ,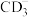 中心原子的杂化方式为
中心原子的杂化方式为___________ ,分子空间构型为_______________ 。
(4)B、C、D、E四种元素的原子半径由大到小的顺序:____________ (填元素符号)。
(5)气态F2+比气态G2+再失去一个电子难,原因是____________ 。
(6)下列关于B2A4的说法中正确的是____________(填序号)。
| A.元素原子是元素周期表中半径最小的原子 |
| B.基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| C.元素原子最高能级的不同轨道都有电子,且只有一种自旋方向 |
| D.原子核外s能级上的电子总数与p能级上的电子总数相等 |
| E.与D为同主族元素 |
| F.其+2价离子的3d轨道为半充满状态 |
| G.目前年产量最大、使用最广泛的金属 |
(2)F元素位于元素周期的
(3)C元素单质的结构式为
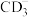 中心原子的杂化方式为
中心原子的杂化方式为(4)B、C、D、E四种元素的原子半径由大到小的顺序:
(5)气态F2+比气态G2+再失去一个电子难,原因是
(6)下列关于B2A4的说法中正确的是____________(填序号)。
| A.B2A4分子中中心原子的杂化类型为sp2 |
| B.B2A4是只由极性键形成的非极性分子 |
| C.B2A4中的所有原子都满足8电子稳定结构 |
| D.B2A4分子中σ键和π键数目比为5:1 |
您最近一年使用:0次
名校
9 . 物质世界缤纷多彩,物质的性质与分子的结构紧密关联。回答下列问题:
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有____________ 种。
(2)O、F、Cl电负性由大到小的顺序为______________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是__________ 。
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是_________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。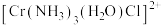 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(5)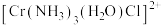 中配体分子NH3、H2O
中配体分子NH3、H2O
①键角:NH3___________ H2O(填“>”或“<”)。
②NH3极易溶于水,原因是____________ 。
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是____________ 原子。设Cr和Al原子半径分别为 和
和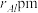 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为________ %(列出计算表达式)。
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有
(2)O、F、Cl电负性由大到小的顺序为
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。
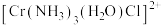 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是(5)
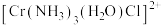 中配体分子NH3、H2O
中配体分子NH3、H2O①键角:NH3
②NH3极易溶于水,原因是
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是
 和
和 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
您最近一年使用:0次
名校
解题方法
10 . 前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)E的元素名称为___________ 。
(2)元素A、B、C中,电负性最大的是___________ (填元素符号 ) 。
(3)BC 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为___________ ,BC 的空间结构为
的空间结构为___________ 。
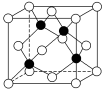
(4)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为___________ g·cm-3(用NA表示阿伏加德罗常数的值)。
(1)E的元素名称为
(2)元素A、B、C中,电负性最大的是
(3)BC
 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为 的空间结构为
的空间结构为(4)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为
您最近一年使用:0次



 (常温)
(常温)